题目内容
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4B
试题分析:A.由于反应初始4 s内A的平均反应速率v(A)="0.005" mol/(L·s),V(B)="V(A)=" 0.005 mol/(L·s),所以4 s时c(B)为(0.8mol ÷2L)-0.005 mol/(L·s)×4s="0.36" mol/L.错误。B.830℃化学平衡常数为1.0.当反应达平衡时,假设c(A)=x,根据化学平衡常数
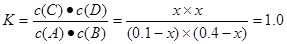 ,解得x=0.08.所以A的转化率为(0.08÷0.1)×100%=80%.正确。C.根据表格的数据可以看出:温度升高,化学平衡常数减小。说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。错误。D.1200℃时A(g)+B(g)
,解得x=0.08.所以A的转化率为(0.08÷0.1)×100%=80%.正确。C.根据表格的数据可以看出:温度升高,化学平衡常数减小。说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。错误。D.1200℃时A(g)+B(g) C(g)+D(g)的平衡常数
C(g)+D(g)的平衡常数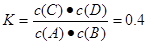 而反应C(g)+D(g)
而反应C(g)+D(g) A(g)+B(g)的平衡常数
A(g)+B(g)的平衡常数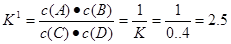 。
。
练习册系列答案
相关题目
 Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
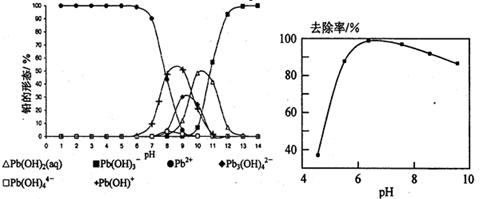
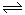 2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表: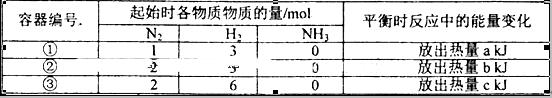
 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1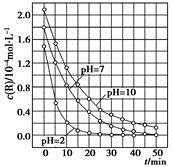
 CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
 。
。  xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
