题目内容
有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:
(1)滴入Ba(OH)2前原混合液中盐酸和硫酸的物质的量浓度.
(2)A点溶液的pH.(lg5=0.7)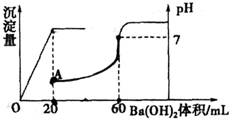
(1)滴入Ba(OH)2前原混合液中盐酸和硫酸的物质的量浓度.
(2)A点溶液的pH.(lg5=0.7)

由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生
H++OH-═H2O,
(1)设硫酸的物质的量为x,则
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.02L×0.025mol?L-1
=
,解得x=0.0005mol,
硫酸的物质的量浓度为
=0.025mol?L-1,
设HCl的物质的量为y,则
H++OH-═H2O
1 1
y 0.04L×2×0.025mol?L-1
=
,解得y=0.002mol,
盐酸的物质的量浓度为
=0.1mol/L,
答:滴入Ba(OH)2前原混合液中盐酸的物质的量浓度为0.1mol?L-1,硫酸的物质的量浓度为0.025mol?L-1;
(2)由图可知,A点硫酸完全反应,氢离子的浓度为
=0.05mol/L,
则pH=-lg0.05=1.3,答:A点溶液的pH为1.3.
H++OH-═H2O,
(1)设硫酸的物质的量为x,则
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.02L×0.025mol?L-1
| 1 |
| 1 |
| x |
| 0.02L×0.025mol/L |
硫酸的物质的量浓度为
| 0.0005mol |
| 0.02L |
设HCl的物质的量为y,则
H++OH-═H2O
1 1
y 0.04L×2×0.025mol?L-1
| 1 |
| 1 |
| y |
| 0.04L×2×0.025mol/L |
盐酸的物质的量浓度为
| 0.002mol |
| 0.02L |
答:滴入Ba(OH)2前原混合液中盐酸的物质的量浓度为0.1mol?L-1,硫酸的物质的量浓度为0.025mol?L-1;
(2)由图可知,A点硫酸完全反应,氢离子的浓度为
| 0.1mol/L×0.02L |
| 0.02L+0.02L |
则pH=-lg0.05=1.3,答:A点溶液的pH为1.3.

练习册系列答案
相关题目
 有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:
有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:

