题目内容
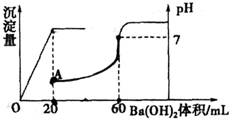
有硫酸和盐酸的混合液共20 mL,在此溶液中滴入0.025 mol·L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如下图,求:?
(1)滴入Ba(OH)2前盐酸和硫酸的物质的量浓度。?
(2)A、B两点溶液的pH。
解析:(1)n(H2SO4)=n(Ba2+)=0.02 L×0.025 mol·L-1=5×10-4 mol?
[H2SO4]=![]() =0.025 mol·L-1?
=0.025 mol·L-1?
n(HCl)=2{n〔Ba(OH)2〕-n(H2SO4)}=2×(0.06 L×0.025 mol·L-1-0.02 L×0.025 mol·L-1)=0.002 mol,
c(HCl)=![]() =0.1 mol·L-1?
=0.1 mol·L-1?
(2)A点,溶液呈酸性?
[H+]=![]() =0.05 mol·L-1,pH=2-lg5=1.3,同理可求B点:pH=1.8。?
=0.05 mol·L-1,pH=2-lg5=1.3,同理可求B点:pH=1.8。?
答案:
(1)[HCl]=0.1 mol·L-1 [H2SO4]=0.025 mol·L-1?
(2)A点pH=1.3? B点pH=1.8

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
 有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:
有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求: