题目内容
8.硼、镁及其化合物在工农业生产中应用广泛.已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程如图.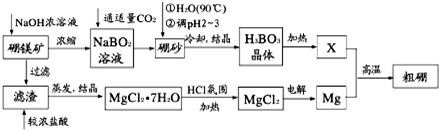
回答下列有关问题:
(1)硼砂中B的化合价为+3,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为B4O72-+2H++5H2O=4H3BO3.
(2)X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为B2O3+3Mg$\frac{\underline{\;高温\;}}{\;}$2B+3MgO,MgCl2•7H2O脱水需要在HCl氛围中加热,其目的是防止MgCl2水解生成Mg(OH)2.
(3)硼氢化钠是一种常用的还原剂,它与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑.硼氢化钠在液中能把许多金属离子还原为金属单质,为了抑制它与水的反应,反应应在碱性(填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:
8Au3++3BH4-+24OH-═8Au↓+3BO2-+18H2O.
分析 硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程中硼镁矿加入氢氧化钠浓溶液过滤得到氯化镁,加入浓盐酸溶解通过蒸发浓缩得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,电解得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,溶于热水后,用H2SO4调pH2~3制取H3BO3,加热得到B2O3,
(1)硼砂的化学式为Na2B4O7•10H2O,依据元素化合价标注计算硼元素化合价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3
(2)X为H3BO3晶体加热脱水的产物,应为B2O3,B2O3与Mg反应制取粗硼与氧化镁;氯化镁在水溶液中水解生成氢氧化镁;
(3)BO2-易与H+结合,则碱性溶液可抑制它与水的反应,利用电子守恒及电荷守恒、质量守恒定律来配平离子反应方程式.
解答 解:(1)硼砂的化学式为Na2B4O7•10H2O,钠元素化合价为+1价,氧元素化合价-2价,依据化合价代数和计算得到硼元素化合价为+3价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3,
故答案为:+3;B4O72-+2H++5H2O=4H3BO3;
(2)X为H3BO3晶体加热脱水的产物,应为B2O3,B2O3与Mg反应制取粗硼与氧化镁,反应方程式为B2O3+3Mg$\frac{\underline{\;高温\;}}{\;}$2B+3MgO,MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁,
故答案为:B2O3+3Mg$\frac{\underline{\;高温\;}}{\;}$2B+3MgO;防止MgCl2水解生成Mg(OH)2;
(3)因BO2-易与H+结合,则碱性溶液可抑制它与水的反应,由Au的化合价由+3降低为0,BH4-中H元素从-1价升高到+1,则由电子守恒可得8Au3++3BH4-→8Au↓+3BO2-,
碱性溶液中氢氧根离子参加反应,再由电荷守恒和质量守恒定律可得8Au3++3BH4-+24OH-═8Au↓+3BO2-+18H2O,
故答案为:碱性;8;3;24OH-;8;3;18H2O.
点评 本题考查氧化还原反应、盐类的水解,明确元素的化合价是解答本题的关键,并注意习题中的信息HBO2是弱酸及平衡移动来分析,题目难度中等.

| A. | 邻甲基苯酚能与NaOH溶液反应而苯甲醇不能 | |
| B. | 等物质的量的乙醇和乙二醇与足量的金属钠反应,后者产生的氢气比前者多 | |
| C. | 苯与液溴在催化剂存在下发生反应,而苯酚与浓溴水混合就能发生反应 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 |
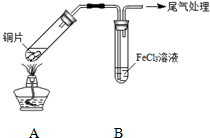 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
| A. | 所有的盐溶液均呈中性 | |
| B. | 盐类的水解过程破坏了纯水的电离平衡 | |
| C. | 盐类的水解是酸碱中和反应的逆反应 | |
| D. | 升高温度可以促进盐类的水解 |
| A. | 以Mg2+为中心的大环配合物叶绿素能催化光合作用 | |
| B. | Fe2+的卟啉配合物是输送O2的血红素 | |
| C. | 三价铁离子和硫氰酸根离子形成的配离子常用于人造血液 | |
| D. | 钴离子的卟啉配合物是人体需要的一种维生素 |
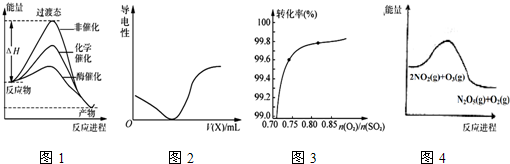
| A. | 由图1所示曲线可知,化学催化比酶催化的效果好 | |
| B. | 在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 | |
| C. | 其它条件不变,关于反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),图3中纵坐标表示O2的转化率 | |
| D. | 图4的反应升高温度,平衡常数减小 |
 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;
;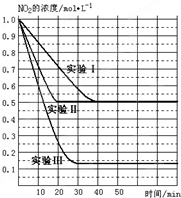 某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?
某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?