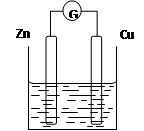
题目内容
(1)现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质和特点,判断(A)和(B)分别能否设计成原电池 ;
②如果不能,说明其原因 。
(2)选择适宜的材料和试剂设计一个原电池,电池的总反应为:Zn + CuSO4 = ZnSO4 + Cu,分别写出电池两极的电极反应式,正极 ,负极 。
(A)NaOH + HCl =" NaCl" + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质和特点,判断(A)和(B)分别能否设计成原电池 ;
②如果不能,说明其原因 。
(2)选择适宜的材料和试剂设计一个原电池,电池的总反应为:Zn + CuSO4 = ZnSO4 + Cu,分别写出电池两极的电极反应式,正极 ,负极 。
(10分)(1)①(A)不能,(B)可以 (4分)
②(A)的反应是非氧化还原反应,没有电子转移(其他合理答案也给分)(2分)
(2)负极:Zn–2e-= Zn2+ (2分) 正极:Cu2+ + 2e-=Cu (2分)
②(A)的反应是非氧化还原反应,没有电子转移(其他合理答案也给分)(2分)
(2)负极:Zn–2e-= Zn2+ (2分) 正极:Cu2+ + 2e-=Cu (2分)
试题分析:(1)只有氧化还原反应才能设计成原电池,(A)的反应是非氧化还原反应,没有电子转移,不能设计成原电池。(B)反应是氧化还原反应,可以设计成原电池。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。关键方程式可知,在反应中锌失去电子,是还原剂,做负极,电极反应式是Zn–2e-= Zn2+;正极得到电子,溶液中的铜离子子正极得到电子,电极反应式是Cu2+ + 2e-=Cu。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。该题的关键是明确原电池的工作原理、构成条件以及电极反应式的书写、电极名称的判断,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范答题能力。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
 (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。