题目内容
(10分)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应达到平衡后测得c(H2)=0.008mol/L。求:(1)该反应的平衡常数。
(2)在同样的温度下,该容器中若通入H2和I2(g)各0.20mol,试求达到平衡状态时H2的转化率
(2)在同样的温度下,该容器中若通入H2和I2(g)各0.20mol,试求达到平衡状态时H2的转化率
(1)K=1/4 (2)α(H2)=20%
考查可逆反应的有关计算。
(1)根据反应的方程式可知
H2(g)+I2(g) 2HI(g)
2HI(g)
起始量(mol) 0.1 0.1 0
转化量(mol) x x 2x
平衡量(mol) 0.08 0.10-x 2x
所以有 0.10-x=0.08
解得x=0.02mol
所以平衡时氢气、碘和碘化氢的浓度分别是0.008mol/L、0.008mol/L、0.004mol/L
因此平衡常数K=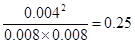
(2)由于反应前后体积不变,所以容器中若通入H2和I2(g)各0.20mol,平衡还是等效的,因此达到平衡状态时H2的转化率不变,仍然是0.02÷0.1=0.2,即20%。
(1)根据反应的方程式可知
H2(g)+I2(g)
 2HI(g)
2HI(g)起始量(mol) 0.1 0.1 0
转化量(mol) x x 2x
平衡量(mol) 0.08 0.10-x 2x
所以有 0.10-x=0.08
解得x=0.02mol
所以平衡时氢气、碘和碘化氢的浓度分别是0.008mol/L、0.008mol/L、0.004mol/L
因此平衡常数K=
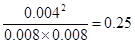
(2)由于反应前后体积不变,所以容器中若通入H2和I2(g)各0.20mol,平衡还是等效的,因此达到平衡状态时H2的转化率不变,仍然是0.02÷0.1=0.2,即20%。

练习册系列答案
相关题目
 a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
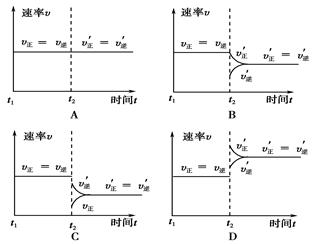
 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )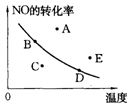
 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算: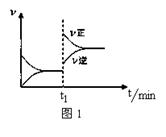
 2SO3(g) ΔH<0,t1时刻升高温度
2SO3(g) ΔH<0,t1时刻升高温度 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表: 2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( ) 2C(g) ΔH<0。向同温、同体积的三个密闭容器中分别充入气体(甲) 2 mol A和1 mol B;(乙) 1 mol A和0.5 molB ;(丙) 2 mol C:恒温、恒容下反应达平衡时,下列关系一定正确的是 ( )
2C(g) ΔH<0。向同温、同体积的三个密闭容器中分别充入气体(甲) 2 mol A和1 mol B;(乙) 1 mol A和0.5 molB ;(丙) 2 mol C:恒温、恒容下反应达平衡时,下列关系一定正确的是 ( )