题目内容
【题目】回答下列问题:
(1)某温度时,测得0.01mol/L的NaOH溶液pH=13,该温度下水的Kw=__。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25.0kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-48.0kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__。
(3)已知25℃时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液pH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为__mol/L。
(4)生活中明矾常作净水剂,其净水的原理是__(用离子方程式表示)。
(5)常温下,取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,测得混合溶液后的pH=5,写出MOH的电离方程式:__。
(6)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H2A)>c(A2-)
①该溶液中c(H+)__c(OH-)(填“>”、“<”或“=”)
②作出上述判断的依据是__(用文字解释)。
【答案】10-15 FeO(s)+CO(g)=CO2(g)+Fe(s) △H=-218kJ/mol 1.8×10-7 Al3++3H2O![]() Al(OH)3(胶体)+3H+ MOH
Al(OH)3(胶体)+3H+ MOH![]() M++OH- < 电离程度小于水解程度
M++OH- < 电离程度小于水解程度
【解析】
(1)根据溶液的pH及水的离子积常数表达式分析计算;
(2)根据盖斯定律及热化学方程式书写规律分析解答;
(3)根据沉淀溶解平衡原理及溶度积常数计算解答;
(4)根据明矾净水的原理分析解答;
(5)根据盐溶液的酸碱性判断酸与碱的强弱,进而书写电离方程式;
(6)根据盐溶液中离子浓度的大小分析水解与电离程度大小,判断溶液的酸碱性。
(1) 某温度时,测得0.01molL-1的NaOH溶液的pH=13,溶液中水电离出的氢离子浓度c(H+)=10-13mol/L,溶液中氢氧根离子浓度c(OH-)=0.01mol/L,该温度下水的Kw=c(H+)×c(OH-)=1.0×10-15,故答案为:10-15
(2) 已知①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25.0kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-48.0kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
依据盖斯定律计算,(①×3-③×2+②)×![]() ,得到CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式为:FeO(s)+CO(g)=CO2(g)+Fe(s) △H=-218kJ/mol,故答案为:FeO(s)+CO(g)=CO2(g)+Fe(s) △H=-218kJ/mol;
,得到CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式为:FeO(s)+CO(g)=CO2(g)+Fe(s) △H=-218kJ/mol,故答案为:FeO(s)+CO(g)=CO2(g)+Fe(s) △H=-218kJ/mol;
(3) 已知25°C时Ksp(Mg(OH)2)=1.8×10-11,当控制溶液pH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度依据溶度积常数计算,c(OH-)=![]() mol/L,Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-)=1.8×10-11,c(Mg2+)=
mol/L,Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-)=1.8×10-11,c(Mg2+)=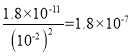 molL-1 ;故答案为:1.8×10-7 ;
molL-1 ;故答案为:1.8×10-7 ;
(4) 生活中明矾常作净水剂,其净水的原理是明矾中铝离子水解生成氢氧化铝胶体,胶体具有吸附性,反应的离子方程式为Al3++3H2O![]() Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O
Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(5) 0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,则完全反应生成MCl, pH=5说明溶液呈酸性,MOH为弱碱,MOH不完全电离,电离方程式为:MOH![]() M++OH-,故答案为:MOH
M++OH-,故答案为:MOH![]() M++OH-;
M++OH-;
(6) ①NaHA溶液中,HA-离子既电离也水解,电离产生A2-,水解生成H2A,由于c(H2A)>c(A2-),说明其电离程度小于水解程度,溶液呈碱性,c(H+)<c(OH-);
② NaHA溶液中,HA-离子既电离也水解,电离产生A2-,水解生成H2A,溶液显碱性,说明其电离程度小于水解程度,故答案为:<;电离程度小于水解程度。