题目内容
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJmol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJmol-1
H2O(l)=H2O(g) △H=+44kJmol-1
则反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的△H=_________
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
①还原产物的化学式为_________
②配平后的化学方程式是__________________
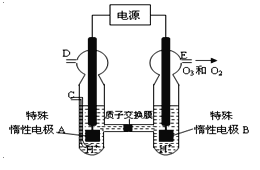
(4)O3 可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
【答案】(1)H2O2+2I-+2H+=I2+2H2O(1分)
(2)![]() (1分)(3)-643.28kJmol-1(1分)
(1分)(3)-643.28kJmol-1(1分)
①KOH(1分)②O3+2KI+H2O=2KOH+I2+O2(2分)
(4)①A(1分)②50%(1分)③O2+4H++4e-=2H2O(2分)
【解析】
试题分析:(1)酸性条件下H2O2氧化碘化钾生成碘单质和水,反应的离子方程式为H2O2+2I-+2H+==I2+2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为:![]() 。
。
(3)反应①N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ mol-1、反应②H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1、反应③H2O(l)=H2O(g) △H=+44kJ mol-1,根据盖斯定律可知,①+②×2+③×2即得到N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)的 △H=-534 kJ·mol—1-98.64 kJ·mol—1×+44 kJ·mol—1×2=-643.28kJ·mol—1。
(3)①该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物;②碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为O3+2KI+H2O=2KOH+I2+O2 ;
(4)①由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,A为阴极,电极反应为2H++2e-═H2↑,答案为A;
②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5mol,E处为氧气、臭氧,体积共为4.48L,物质的量为0.2mol,令臭氧的体积为xL,根据电子转移守恒有0.5×2=x×3×2+(0.2-x)×2×2,解得x=0.5mol-2×0.2mol=0.1,所以E处收集的气体中O3所占的体积分数为0.1mol÷0.2mol×100%=50%.
③C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案【题目】按要求填空:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是 ,违反了洪特规则的是 .
A. |
B. |
C. |
D. |
E.![]()
F.![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 .
(3)用符号“>”“<”或“=”表示下列各项关系.
①第一电离能:Na Mg,Mg Ca.
②电负性:O F,F Cl.
③能量高低:ns (n+1)s,ns np.