题目内容
【题目】Fritz Haber在合成氨领域的贡献距今已经110周年,氮族元素及其化合物应用广泛。
(1)在基态13N原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是________,与NO3-互为等电子体的分子为__________。液氨中存在电离平衡2NH3![]() NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
(3)我国科学工作者实现世界首次全氮阴离子(N5-)金属盐Co(N5)2(H2O)4·4H2O的合成,其结构如图所示,可知N5-的化学键类型有______________。

(4)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的化学式为__________,其晶体密度为__________(设阿伏加德罗常数的值为NA,列出计算式)g·cm-3。

【答案】2 哑铃(纺锤) NH3 SO3或BF3 V形 sp3 液氨存在分子间氢键,沸点高于PH3,故NH3比PH3更易液化 σ键、π键 HgNH4Cl3 1×325.5/NA×(a×10-10)2×c×10-10
【解析】
(1)氮原子的电子排布是1s22s22p3,可知核外存在2对自旋相反的电子。核外电子占据的最高能级为2p,电子云轮廓图为哑铃(纺锤)形;
(2) NH3、NO3-、NO2-中,中心原子价层电子对数分别为3、4、4,不同于其他两种粒子的是NH3;等电子体要求原子总数相同、价原子总数相同,与NO3-互为等电子体的分子为SO3或BF3;NH![]() 的中心原子N的价层电子对数为4,孤电子对数为2,可知空间构型为V形;氨气分子中氮原子价层电子对个数=3+
的中心原子N的价层电子对数为4,孤电子对数为2,可知空间构型为V形;氨气分子中氮原子价层电子对个数=3+![]() ×(5-3×1)=4,所以N原子采用sp3杂化;液氨存在分子间氢键,沸点高于PH3,故NH3比PH3更易液化;
×(5-3×1)=4,所以N原子采用sp3杂化;液氨存在分子间氢键,沸点高于PH3,故NH3比PH3更易液化;
(3)由结构可知,存在的化学键为σ键、π键;
(4)由均摊法可知,1个晶胞中Hg2+、NH![]() 、Cl-个数分别为1、1、3,则晶体X的化学式为HgNH4Cl3;
、Cl-个数分别为1、1、3,则晶体X的化学式为HgNH4Cl3;
晶体密度ρ=N M/NAV,又M(HgNH4Cl3)=325.5 g/mol,V=(a×10-10)2·c×10-10 cm3。
故ρ=1×325.5/NA×(a×10-10)2×c×10-10g·cm-3。

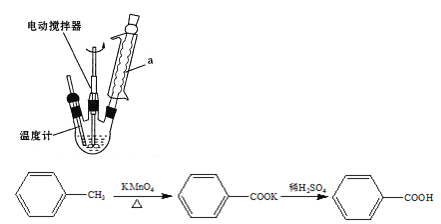
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理及装置示意图(加热、 夹持及辅助仪器省略)和一些相关信息如下:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | ﹣95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
Ⅰ.在b 中加入 2.7 mL 甲苯、100 mL水和几片碎瓷片,开动电动搅拌器,a中通水。将b 中的液体加热至沸腾,分批加入 8.5 g 高锰酸钾,继续搅拌约5 h,停止加热和搅拌,静置。
Ⅱ.在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,再用浓盐酸酸化,苯甲酸全部析出后减压过滤,冷水洗涤,干燥,得到粗产品。
Ⅲ.称取m g产品,配成 100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。请回答下列问题:
(1)装置a的作用___________
(2)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用_______,请用离子方式表示该反应原理_____。
(3)产品减压过滤时用冷水洗涤的原因是_____________
(4)选用下列________(选填字母)操作,可以将粗产品进一步提纯。
A 溶于水后过滤 B 溶于乙醇后蒸馏
C 用甲苯萃取后分液 D 升华
(5)测定纯度步骤中,滴定终点溶液的颜色变化是__。若m=1.200 g,滴定时用去0.1200 mol·L-1 标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为______。