题目内容
9.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.(1)写出下列仪器的名称:
a.蒸馏烧瓶
b.冷凝管
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是酒精灯,将仪器补充完整后进行实验,冷凝水由g(填f或g)口通入.
(3)现需配制0.1mol/LNaOH溶液450mL,装置Ⅱ是某同学转移溶液的示意图.

①图中的错误是未用玻璃棒引流.所需的容量瓶的规格500mL.
②根据计算得知,所需NaOH的质量为2.0 g.
③配制时,其正确的操作顺序是BCAFED(用字母表示,每个字母只能用一次).
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解,冷却
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④在溶液配制过程中,下列操作引起溶液浓度偏大的是A.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移时不小心将溶液洒至瓶外
D.定容摇匀后发现液面低于容量瓶的刻度线,继续加水至刻度线.
分析 (1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,根据仪器的结构特点判断;
(2)分离四氯化碳和酒精的混合物必须用酒精灯加热,实质是蒸馏过程,冷凝管下口是进水口,上口是出水口,据此即可解答;
(3)①根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误,并判断使用仪器;
②根据n=CV和m=nM来计算;
③根据配制一定物质的量浓度的溶液的方法,判断操作步骤;
④根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高.
解答 解:(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,a为蒸馏烧瓶,b为冷凝管,e为锥形瓶,
故答案为:蒸馏烧瓶;冷凝管;
(2)分离四氯化碳和酒精的混合物用蒸馏的方法分离,必须用酒精灯,温度计应位于蒸馏烧瓶支管口,冷凝管下口是进水口,上口是出水口,即由g口通入.
故答案为:酒精灯; g;
(3)①配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.由于无450ml容量瓶,故要选用500ml容量瓶,故使用的容量瓶的规格为500mL,
故答案为:未用玻璃棒引流;500mL;
②由于无450ml容量瓶,故要选用500ml容量瓶,配制出500ml 0.1mol/L的NaOH溶液,所需的NaOH的物质的量n=CV=0.5L×0.1mol/L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g,当只缺少量晶体时,其操作方法是轻拍手腕,使少量晶体落入烧杯中,故答案为:2.0;
③根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶可知正确的操作步骤是BCAFED,故答案为:BCAFED;
④A.定容时俯视容量瓶刻度线,则容易体积偏小,浓度偏高,故A正确;
B.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B错误;
C.转移时不小心将溶液洒至瓶外,则造成溶质的损失,浓度偏小,故C错误;
D.定容摇匀后发现液面低于容量瓶的刻度线是正常的,继续加水至刻度线导致浓度偏低,故D错误.
故选A.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 0.4 mol O2 | B. | 16g CH4 | ||
| C. | 3.01×1023个H2SO4 | D. | 标准状况下44.8L CO2 |
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出物质B、C的化学式:BH2SO4 CBa(OH)2
(2)写出下列反应的离子方程式:
①A溶液与C溶液反应:Ba2++CO32-=BaCO3↓;
②B溶液与碳酸氢钠溶液反应:H++HCO3-=H2O+CO2↑.
③将少量的C溶液滴入足量的碳酸氢钾溶液反应:Ba2++2OH-+2HCO3-=2H2O+CO32-+BaCO3↓.
| A. | 硫离子的核外电子排布式:1s22s22p6 | |
| B. | 碳-14的原子组成符号:${\;}_{6}^{14}$C | |
| C. | 碳原子的外围电子轨道表示式: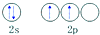 | |
| D. | Cl-的结构示意图: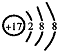 |
| A. | 由于碘在乙醇中的溶解度较大,所以可用乙醇把碘水中的碘萃取出来 | |
| B. | 水的沸点为100℃,乙醇的沸点为78.5℃,所以用加热蒸馏的方法使含水乙醇变为无水乙醇 | |
| C. | 由于汽油和水不互溶,因此可用分液的方法将二者分离 | |
| D. | NaCl溶液度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl |