题目内容
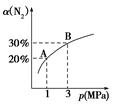
可逆反应A(s)+B C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体,正反应是吸热反应
C.B是气体,C是固体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
B
解析试题分析:A.若B是固体,C是固体,由于A是固体,则改变压强化学平衡不移动。B的转化率不变。错误。B.由于增大压强,B的转化率增大,那么B的状态为气态。正反应方向为气体体积减小的反应。所以C为固体。在压强一定时,由于升高温度,B的转化率增大。说明升高温度化学平衡正向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。所以正反应是吸热反应。正确。C.B是气体,C是固体,正反应方向为气体体积减小的反应。增大压强B的转化率增大。若正反应是放热反应。则升高温度,平衡逆向移动,B的转化率降低。与题干矛盾。错误。D.若B、C都是气体,则该反应为反应前后气体体积相等的反应。改变压强,化学平衡不移动,B的转化率不变。与已知条件不符合。错误。
考点:考查压强、温度对物质转化率平衡的移动、物质的状态的关系的知识。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案已知4NH3(g)+5O2(g) 4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是( )
4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是( )
A.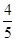 v(NH3)=v(O2) v(NH3)=v(O2) | B.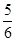 v(O2)=v(H2O) v(O2)=v(H2O) |
C.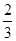 v(NH3)=v(H2O) v(NH3)=v(H2O) | D.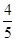 v(O2)=v(NO) v(O2)=v(NO) |
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如
将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
下列有关叙述正确的是( )
A.b<0
B.在973 K下增大压强,K2增大
C.a>b
D.在常温下反应①一定能自发进行
已知200 ℃,反应2NO(g)+2CO(g) 2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )
2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )
| | c(NO) | c(CO) | c(CO2) | c(N2) |
| A | 1 | 1 | 0.1 | 0.1 |
| B | 0.1 | 0.1 | 0.1 | 0.1 |
| C | 0.2 | 0.1 | 0.2 | 1 |
| D | 0.3 | 0.2 | 0.2 | 0.3 |
已知可逆反应X(g)+2Y(g)  Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
| A.a点正反应速率大于逆反应速率 |
| B.增大X的浓度,X的转化率增大 |
| C.容器中压强恒定时,不能说明反应已达平衡状态 |
| D.保持温度和密闭容器的容积不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小 |
反应2X(g)+Y(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )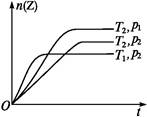
| A.T1<T2,p1<p2 | B.T1<T2,p1>p2 |
| C.T1>T2,p1>p2 | D.T1>T2,p1<p2 |
 pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )