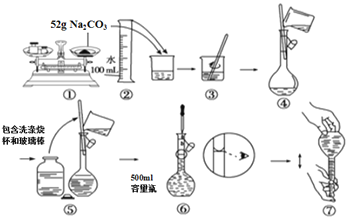
题目内容
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
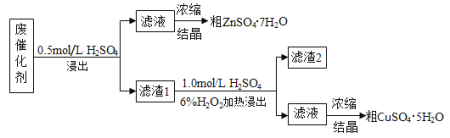
已知:ZnS与稀硫酸反应,且化合价不变;CuS不与稀硫酸反应。回答下列问题:
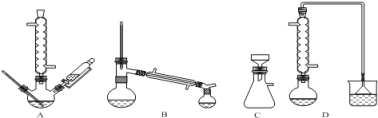
(1)在下列装置中,第一次浸出必须用 。(填标号)
(2)第二次浸出时,向盛有滤渣1的反应器中先加入稀H2SO4,后滴入H2O2溶液。
①写出第二次浸出(有单质生成)的化学方程式 。
②若滴加H2SO4和H2O2顺序相反,会造成 。
③滤渣2的主要成分是 。
CuS+H2O2+H2SO4=CuSO4+S+2H2O
(3)浓缩硫酸锌、硫酸铜溶液使用的主要仪器名称是 。
(4)该同学在实验完成之后,得到1.50g CuSO4·5H2O,则铜的回收率为 。
【答案】(1)D(2)①CuS++H2O2+H2SO4=CuSO4+S+2H2O
②H2O2与固体颗粒接触分解③S和SiO2(3)蒸发皿(4)30%
【解析】
试题分析:(1)根据题目化学工艺流程知,第一次浸出发生反应:ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑,有有毒的生成,必须用氢氧化钠溶液进行尾气处理,选D装置;
(2)①第二次浸出时发生反应为CuS++H2O2+H2SO4=CuSO4+S+2H2O;②第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液.若顺序相反,会造成H2O2与固体颗粒接触分解;③二氧化硅不与硫酸反应,滤渣2的主要成分是S和SiO2;
(3)浓缩硫酸锌、硫酸铜溶液使用仪器为蒸发皿;
(4)废催化剂中Cu的物质的量为15.0g×12.8%÷96g/mol=0.02mol,1.5g CuSO4﹒5H2O中Cu的物质含量的为1.5g÷250g/mol=0.006mol,则铜的回收率为![]() ×100%=30%。
×100%=30%。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案