题目内容
已知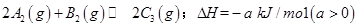 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 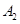 和1mol
和1mol 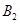 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后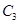 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。
(1)比较a______b(填>、=、<)
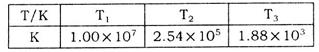
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
若在原来的容器中,只加入2mol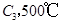 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ,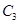 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol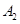 和2mol
和2mol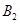 B.4mol
B.4mol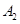 、2mol
、2mol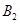 和2mol
和2mol 
C.4mol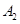 和4mol
和4mol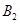 D.6mol
D.6mol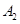 和4mol
和4mol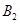
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出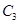 气体 B.适当升高温度
气体 B.适当升高温度
C.增大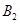 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂
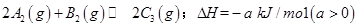 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 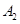 和1mol
和1mol 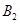 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后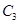 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。(1)比较a______b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
若在原来的容器中,只加入2mol
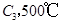 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ,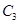 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol
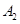 和2mol
和2mol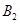 B.4mol
B.4mol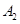 、2mol
、2mol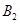 和2mol
和2mol 
C.4mol
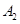 和4mol
和4mol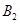 D.6mol
D.6mol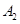 和4mol
和4mol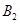
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出
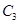 气体 B.适当升高温度
气体 B.适当升高温度C.增大
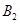 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂(1) > (1分) (2)< (1分) = (1分) (3) D (2分) (4) C (2分)
试题分析:(1)由于此反应是可逆反应,加入的2molA2和1molB2只能部分反应,故a>b。
(2)该反应为放热反应,温度升高,平衡常数减小,T1时的平衡常数大于T2时的平衡常数,所以T1<T2
(3)在相同条件下要想得到2akJ热量,需要4molA2和2molB2反应,因为该反应为可逆反应,所以加入反应物一定大于4molA2和2molB2,只有D项符合。
(4)A、及时分离出C3气体 ,并不能加快反应速率,错误;B、适当升高温度,化学反应速率增大,因为该反应为放热反应,平衡向逆反应方向移动,错误;C项增大B2的浓度,使该反应的反应速率增大,且平衡向正反应方向移动,正确;D、加入催化剂可以提高反应速率,但不能改变平衡,错误。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目

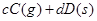
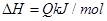 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )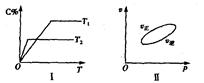
 CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。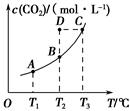
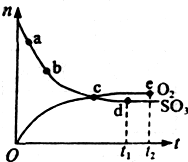
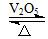 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。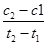
 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图: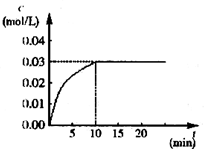
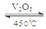 2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) 
 xC(气)+2D(气)
xC(气)+2D(气)