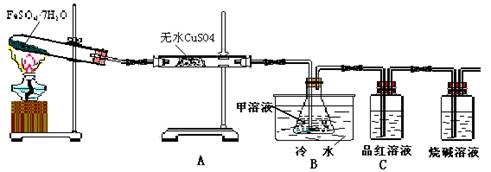
题目内容
已知FeSO4?7H2O晶体在加热条件下发生如下反应:2FeSO4?7H2O
| ||

(1)用于检验SO2气体的装置是
(2)利用装置B可以确认的产物是
①足量澄清石灰水 ②足量氯化钡溶液 ③足量硝酸钡溶液
该装置中冷水的作用是
(3)为探究Fe2O3的性质和用途,取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为
分析:依据实验目的可以推断,实验装置A中无水硫酸铜检验产无水,装置C品红溶液检验SO2,装置B中甲溶液用于检验SO3,通过检验硫酸根进而证明产物SO3,SO3与H2O的反应是放热反应,会形成酸雾,含有铁离子的饱和溶液逐滴加入沸水中加热直至液体呈现红褐色,是制备氢氧化铁胶体的方法,利用丁达尔效应来检验胶体.
解答:解:(1)二氧化硫能使品红溶液褪色,因而检验二氧化硫通常红品红溶液,无水无水CuSO4白色粉末与水反应得到蓝色CuSO4?5H2O,因而常用无水CuSO4白色粉末检验水蒸汽,
故答案为:C;无水CuSO4白色粉末变为蓝色;
(2)实验装置A中无水硫酸铜检验产无水,装置C品红溶液检验SO2,那么装置B中甲溶液肯定用于检验SO3;SO3溶于水生成硫酸,硫酸根离子和钡离子反应产生白色硫酸钡沉淀,由于硝酸具有强氧化性,可以吸收SO2妨碍SO2验证,因而不选足量硝酸钡溶液;SO3与水反应放出大量热,形成酸雾影响SO3的吸收,降低温度可降低酸雾的影响,
故答案为:SO3;②;SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收;
(3)制备氢氧化铁胶体的方法是将有铁离子的饱和溶液逐滴加入沸水中加热直至液体呈现红褐色,得到的氢氧化铁胶体为红褐色,利用丁达尔效应是检验胶体的最简单方法,用一束光照射,若出现一条明显的“光路”即为丁达尔现象,
故答案为:红褐色液体;用一束光照射,若出现一条明显的光路,则证明该分散系为胶体.
故答案为:C;无水CuSO4白色粉末变为蓝色;
(2)实验装置A中无水硫酸铜检验产无水,装置C品红溶液检验SO2,那么装置B中甲溶液肯定用于检验SO3;SO3溶于水生成硫酸,硫酸根离子和钡离子反应产生白色硫酸钡沉淀,由于硝酸具有强氧化性,可以吸收SO2妨碍SO2验证,因而不选足量硝酸钡溶液;SO3与水反应放出大量热,形成酸雾影响SO3的吸收,降低温度可降低酸雾的影响,
故答案为:SO3;②;SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收;
(3)制备氢氧化铁胶体的方法是将有铁离子的饱和溶液逐滴加入沸水中加热直至液体呈现红褐色,得到的氢氧化铁胶体为红褐色,利用丁达尔效应是检验胶体的最简单方法,用一束光照射,若出现一条明显的“光路”即为丁达尔现象,
故答案为:红褐色液体;用一束光照射,若出现一条明显的光路,则证明该分散系为胶体.
点评:此题涉及常见气体的和硫酸根离子的检验,胶体的制备和胶体的性质,均比较基础,难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
 Fe2O3+SO2↑+SO3↑+14H2O↑;下图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O↑;下图的装置可用来检验上述反应中所有的气体产物,请回答下列问题: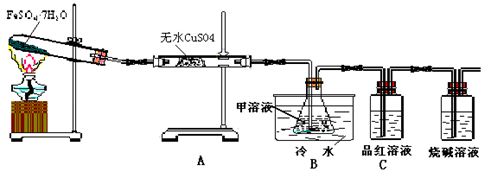

 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
 Fe2O3
+ SO2↑+SO3↑+14H2O↑;下图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3
+ SO2↑+SO3↑+14H2O↑;下图的装置可用来检验上述反应中所有的气体产物,请回答下列问题: