题目内容
【题目】(16分)磷的单质及其化合物在生产、生活中有着重要的用途。回答下列问题:
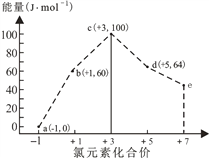
(1)直链低聚磷酸盐的化学式可表示为M(n+2)PnOx(M为+1价金属离子),则x= (用n表示)。
(2)H3PO2及NaH2PO2具有较强还原性,均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①H3PO2是一元弱酸,写出其电离方程式: 。NaH2PO2水溶液显_________(填“酸性”、“中性”、或者“碱性”)。
②H3PO2中,磷元素的化合价为_____,在碱性条件下,次磷酸盐可用于化学镀银,配平反应的离子方程式: ![]() + Ag+ +
+ Ag+ + ![]() + Ag↓ + 。
+ Ag↓ + 。
(3)H3PO2可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
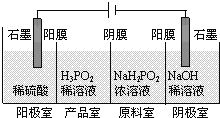
①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③得到1 mol H3PO2的同时,阴极室制得NaOH质量为________g。
(4)含磷(主要为H3PO4、磷酸盐等)废水需加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(PO43)=4×107 mol·L1,则溶液中c(Ca2+)= mol·L1。(已知Ksp[Ca3(PO4)2]=2×1029)
【答案】除标注外,其余每空均2分
(1)3n+1
(2)①H3PO2![]() H++
H++![]() 碱性(1分)
碱性(1分)
②+1(1分) 1 4 6OH 1 4 4H2O
(3)①4OH4eO2↑+2H2O
②阳极室的H+穿过阳膜扩散至产品室,原料室的![]() 穿过阴膜扩散至产品室,二者反应生成H3PO2
穿过阴膜扩散至产品室,二者反应生成H3PO2
③40
(4)5×106
【解析】
试题分析:
(1)根据正负化合价代数和为0可得结果;
(2)①H3PO2是一元弱酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2![]()
![]() +H+;由于H3PO2是一元弱酸,所以NaH2PO2为一元强碱和一元弱酸形成的正盐,所以该盐溶液由于H2PO2发生水解呈碱性。
+H+;由于H3PO2是一元弱酸,所以NaH2PO2为一元强碱和一元弱酸形成的正盐,所以该盐溶液由于H2PO2发生水解呈碱性。
②H3PO2中,元素正负化合价为0,其中氢元素为+1价,氧元素为2价,则P元素的化合价为+1价;该反应是氧化还原反应,同时也是离子反应,根据电子守恒、电荷守恒及原子守恒,可得反应的方程式是:![]() +4Ag++6OH
+4Ag++6OH![]() +4Ag↓+4H2O。
+4Ag↓+4H2O。
(3)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH4eO2↑+2H2O;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的![]() 穿过阴膜扩散至产品室,二者反应生成H3PO2,即
穿过阴膜扩散至产品室,二者反应生成H3PO2,即![]() +H+H3PO2;
+H+H3PO2;
③阴极上氢离子得电子发生还原反应,电极反应式为2H2O+2eH2↑+2OH,当得到1 mol H3PO2的同时转移1 mol H+,即反应中转移电子数为1 mol,则阴极室生成1 mol NaOH,质量为40 g;
(4)根据Ksp[Ca3(PO4)2]= c2(![]() )×c3(Ca2+)=2×1029,因c(
)×c3(Ca2+)=2×1029,因c(![]() )=4×107 mol·L1,则c(Ca2+)=5×106 mol·L1。
)=4×107 mol·L1,则c(Ca2+)=5×106 mol·L1。