题目内容
18.一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s)+CO2?2CO(g),不能判断反应已经达到化学平衡状态的是( )| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,结合反应的特点进行分析.
解答 解:A.当v(CO2)=v(CO),正逆反应速率不等,没有达到平衡状态,故A选;
B.反应前后气体的体积不等,容器中总压强不变,可说明达到平衡状态,故B不选;
C.反应前后气体的质量不等,当达到平衡状态时,容器中混合气体的密度不变,故C不选;
D.达到平衡状态时,各物质的浓度不变,故D不选.
故选A.
点评 本题考查化学平衡状态的判断,题目难度不大,本题注意把握判断是否达到平衡的角度,解答该类题目一定要分析反应的特点,特别是反应前后气体的变化关系以及有无固体参加反应,在做题时不能忽视.

练习册系列答案
相关题目
16.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测稀碱液的,测定值偏小 | |
| B. | 用量筒量取10mLNaOH 溶液时,俯视刻度.量出的体积大于10mL | |
| C. | 使用天平称量时不小心将药品与砝码的位置放反了,称最结果可能是准确的 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
9.根据电解质在溶液中的电离情况,我们划分出了酸、碱、盐,通过学习我们知道酸和碱都有通性,而盐是没有通性的,其本质原因是( )
| A. | 盐不能电离出阳离子 | B. | 盐不能电离出阴离子 | ||
| C. | 盐不能电离出H+或OH- | D. | 盐不能电离出共同的离子 |
13.下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
8.甲烷的燃烧热△H=-890.3kJ•mol-1,1kg CH4在25℃,101kPa时充分燃烧生成液态水放出的热量约为( )
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |

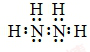 .
.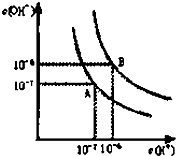 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: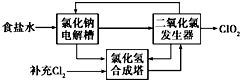 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.