题目内容
将两种硫酸盐按一定质量比混合后制得化合物W,已知W溶于水可电离出K+,Cr3+和 ,现将2.83g W中的Cr3+全部氧化为
,现将2.83g W中的Cr3+全部氧化为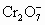 后,这些
后,这些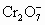 再和过量的KI溶液反应得到3.8g I2(
再和过量的KI溶液反应得到3.8g I2(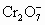 +6I-+14H+=2Cr3++3I2+7H2O);另取2.83g W投入过量的BaCl2溶液中,得到4.66g白色沉淀,由此判断W的化学式为
+6I-+14H+=2Cr3++3I2+7H2O);另取2.83g W投入过量的BaCl2溶液中,得到4.66g白色沉淀,由此判断W的化学式为
[ ]
A.K2Cr(SO4)3
B.K3Cr2(SO4)3
C.KCr3(SO4)3
D.KCr(SO4)2
答案:D
解析:
解析:
|
导解:列出关系式,根据物质的量守恒解. |

练习册系列答案
相关题目
将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为( )
| A.K2SO4·2Cr2(SO4)3 | B.2K2SO4·Cr2(SO4)3 |
| C.K2SO4·Cr2(SO4)3 | D.K2SO4·1/2Cr2(SO4)3 |
 离子,现将2.83g W中的Cr3+离子全部氧化成
离子,现将2.83g W中的Cr3+离子全部氧化成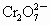 离子,再和过量KI溶液反应(
离子,再和过量KI溶液反应( +6I-+14H+
+6I-+14H+ 2Cr3++3I2+7H2O)得到3.81g I2,另取2.83g W投入过量BaCl2溶液中,得到4.66g沉淀,由此判断W的化学式为:
2Cr3++3I2+7H2O)得到3.81g I2,另取2.83g W投入过量BaCl2溶液中,得到4.66g沉淀,由此判断W的化学式为: