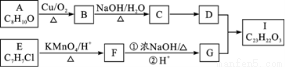
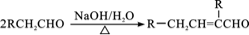
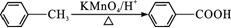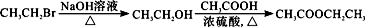题目内容
5.室温下,将pH=1的盐酸和未知浓度的NaOH溶液以体积比1:1混合.所得溶液的pH=2,25.00mL上述NaOH溶液与10.00mL pH=3的某一元弱酸HA溶液恰好完全反应.据此计算:(1)该NaOH溶液的物质的量浓度为0.08mol/L;
(2)该一元弱酸HA的物质的量浓度为0.2mol/L,电离度为0.5%;
(3)该温度在,HA的电离常数为5×10-6.
分析 (1)根据盐酸和氢氧化钠混合溶液中pH计算氢氧化钠浓度;
(2)NaOH溶液25.00mL和pH=3的某一元弱酸HA溶液10.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,结合氢氧化钠和HA的关系式计算HA的浓度;电离度=$\frac{已电离的浓度}{总浓度}$;
(3)电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.
解答 解:(1)设氢氧化钠的浓度为xmol/L,盐酸和氢氧化钠混合溶液中c(H+)=$\frac{0.1V-xV}{2V}$mol/L=0.01mol/L,
解得x=0.08,
故答案为:0.08mol/L;
(2)NaOH溶液25.00mL和pH=3的某一元弱酸HA溶液10.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,
设HA的浓度为ymol/L,
0.08mol/L×0.025L=ymol/L×0.01L,
y=$\frac{0.08mol/L×0.025L}{0.01L}$=0.2mol/L,
电离度=$\frac{已电离的浓度}{总浓度}$×100%=$\frac{1{0}^{-3}}{0.2}$×100%=0.5%;
故答案为:0.025 mol/L;0.5%;
(3)电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.2-1{0}^{-3}}$=5×10-6;
故答案为:5×10-6.
点评 本题考查了pH的简单计算、电离平衡常数的计算等知识点,根据物质间的关系、混合溶液的pH、电离平衡常数公式等知识点来分析解答即可,注意酸碱混合溶液中pH的计算方法,难度中等.

练习册系列答案
相关题目
18.除去试管中银镜的实验方案如下表所列,实验操作中均经振荡、充分反应:
下列分析结论正确的是( )
| 方案 | 实验操作 | 现象 |
| Ⅰ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜较迅速消失 试管口产生红棕色气体 |
| Ⅱ | 将2mL2mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少但未消失 |
| Ⅲ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜较迅速消失 有白色沉淀生成 |
| A. | 方案Ⅰ说明Fe3+ 氧化了Ag | |
| B. | 方案Ⅱ涉及反应之一为Fe3++Ag?Fe2++Ag+ | |
| C. | 方案Ⅱ、Ⅲ对比说明SO42-比Cl-更易沉淀Ag+ | |
| D. | 三个方案对比说明方案Ⅰ是除去银镜的最佳方案 |
19.对物质进行分类是一种简单、有效的科学方法.下列各组物质的分类都正确的是( )
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) | |
| B. | NO2(酸性氧化物)、CH3CHO(有机物)、CO(无机物)、CH3COOCH3(酯) | |
| C. | HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(氧化物)、CH3I(卤代烃) | |
| D. | 液氨(氢化物)、NH4C1(铵盐)、HNO3(含氧酸)、冰水(混合物) |
13.甲烷和乙烯的混合气体100mL,能催化加氢气30mL,则混合气体中含有甲烷( )
| A. | 50mL | B. | 70mL | C. | 30mL | D. | 15mL |
20.常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol•L-1 NaOH溶液 | pH=11 NaOH溶液 | 0.1mol•L-1CH3COOH溶液 | pH=3CH3COOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) | |
| D. | ②④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
10.导致大气污染有很多非金属元素及其化合物,如硫,氮,碳的氧化物及破坏臭氧层的氯等,下列有关氧、硫、碳、氮、氯等非金属元素的各项比较,正确的是( )
| A. | 在常见的化合物中,最高价态从低至高的顺序是:C<N<O=S<Cl | |
| B. | 原子序数从小到大是:C<N<O<S<Cl | |
| C. | 排在元素周期表中所属的主族序数从大至小的是:Cl>O>S>N>C | |
| D. | 原子的最外层电子数由多至少的顺序是:Cl>O=S>N>C |
14.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应.下列说法错误的是( )
| A. | 元素丙的单质可用于冶炼金属 | B. | 甲与丁形成的分子中有非极性分子 | ||
| C. | 简单离子半径:丁>乙>丙 | D. | 甲与乙形成的化合物均有氧化性 |