题目内容
溴化碘(IBr)的化学性质与卤素单质相似,它和水反应的化学方程式:IBr+H2O HBr+HIO。则下列关于IBr的叙述中不正确的是()
| A.IBr是共价化合物 |
| B.在很多反应中,IBr是强氧化剂 |
| C.IBr与水反应时既是氧化剂又是还原剂 |
| D.IBr与氢氧化钠溶液反应生成NaBr、NaIO和H2O |
C
此题必须抓住IBr化学性质与卤素单质(如Cl2)相似及IBr与水反应的化学方程式这两点提示。要认识到IBr是卤素共价化合物(卤素互化物),不是单质,因此不能把IBr完全与卤素单质等同起来,运用卤素单质的思维定势去解题。
IBr与卤素单质的性质关系具体表现在IBr能像卤素单质一样与水反应:Cl2+H2O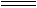 HCl+HClO;IBr+H2O
HCl+HClO;IBr+H2O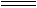 HBr+HIO。
HBr+HIO。
在很多反应中,它们都是强氧化剂:Cl2+2H2O+SO2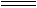 2HCl+H2SO4;IBr+2H2O+SO2
2HCl+H2SO4;IBr+2H2O+SO2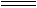 HI+HBr+H2SO4。
HI+HBr+H2SO4。
又由IBr+H2O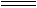 HBr+HIO知:IBr与NaOH作用的产物是NaBr和NaIO。又因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,分子中碘原子显+1价,溴原子显-1价,与跟水反应后产物中溴、碘化合价一致,所以IBr跟水的反应不是氧化还原反应,IBr在此反应中既不是氧化剂又不是还原剂。
HBr+HIO知:IBr与NaOH作用的产物是NaBr和NaIO。又因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,分子中碘原子显+1价,溴原子显-1价,与跟水反应后产物中溴、碘化合价一致,所以IBr跟水的反应不是氧化还原反应,IBr在此反应中既不是氧化剂又不是还原剂。
IBr与卤素单质的性质关系具体表现在IBr能像卤素单质一样与水反应:Cl2+H2O
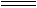 HCl+HClO;IBr+H2O
HCl+HClO;IBr+H2O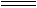 HBr+HIO。
HBr+HIO。在很多反应中,它们都是强氧化剂:Cl2+2H2O+SO2
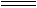 2HCl+H2SO4;IBr+2H2O+SO2
2HCl+H2SO4;IBr+2H2O+SO2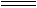 HI+HBr+H2SO4。
HI+HBr+H2SO4。又由IBr+H2O
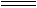 HBr+HIO知:IBr与NaOH作用的产物是NaBr和NaIO。又因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,分子中碘原子显+1价,溴原子显-1价,与跟水反应后产物中溴、碘化合价一致,所以IBr跟水的反应不是氧化还原反应,IBr在此反应中既不是氧化剂又不是还原剂。
HBr+HIO知:IBr与NaOH作用的产物是NaBr和NaIO。又因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,分子中碘原子显+1价,溴原子显-1价,与跟水反应后产物中溴、碘化合价一致,所以IBr跟水的反应不是氧化还原反应,IBr在此反应中既不是氧化剂又不是还原剂。
练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
 MnCl2+ Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系是
MnCl2+ Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系是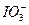 ,煮沸去掉过量的Br2;
,煮沸去掉过量的Br2;