题目内容
【题目】钢铁是用途最广泛的金属材料。
(1)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。写出正极反应式:______。

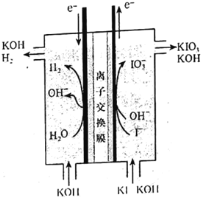
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,装置如图所示。阳极的电极反应式为______;若消耗11.2g铁,则通过离子交换膜的Na+物质的量为______。

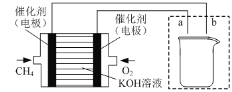
(3)如图所示装置为利用甲烷燃料电池实现在铁质材料上镀锌的一部分,燃料电池的负极反应式为______;在如图所示虚线框内补充完整在铁质材料上镀锌的装置图(注明电极材料和电解质溶液的成分)。_____
【答案】O2+4e-+2H2O=4OH- Fe+8OH--6e-=FeO![]() +4H2O 1.2mol CH4-8e-+10OH-=CO
+4H2O 1.2mol CH4-8e-+10OH-=CO![]() +7H2O
+7H2O 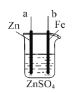
【解析】
(1)铁粉、活性炭和NaCl溶液构成了原电池,发生吸氧腐蚀;
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,铁元素化合价身高,被氧化,则铁作阳极,被氧化得到高铁酸根FeO42-;当消耗1mol铁时,阳极室减少6mol负电荷,则为平衡电荷,会有6molNa+通过离子交换膜移动向阴极;
(3)甲烷燃料电池为碱性环境,甲烷在负极失电子被氧化得到碳酸根;通甲烷的一极为负极,通氧气的一极为正极,电解池中连接电源正极的为阳极,连接电源负极的为阴极,在铁质材料上镀锌时,锌作阳极,铁作阴极,据此解答。
(1)铁粉、活性炭和NaCl溶液构成了原电池,发生吸氧腐蚀,O2在正极得电子发生还原反应,正极反应式为:O2+4e-+2H2O=4OH-;
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,铁元素化合价身高,被氧化,则铁作阳极,阳极的电极反应式为Fe+8OH--6e-=FeO![]() +4H2O,根据电极反应式知,当消耗1mol铁时,阳极室减少6mol负电荷,则为平衡电荷,会有6mol Na+通过离子交换膜移动向阴极;若消耗11.2g铁,即0.2mol铁,则通过离子交换膜的Na+物质的量为1.2mol;
+4H2O,根据电极反应式知,当消耗1mol铁时,阳极室减少6mol负电荷,则为平衡电荷,会有6mol Na+通过离子交换膜移动向阴极;若消耗11.2g铁,即0.2mol铁,则通过离子交换膜的Na+物质的量为1.2mol;
(3)甲烷燃料电池为碱性环境,甲烷在负极失电子被氧化得到碳酸根,负极反应式为CH4-8e-+10OH-=CO32-+7H2O;通甲烷的一极为负极,通氧气的一极为正极,则在电解池中a为阳极,b为阴极,在铁质材料上镀锌时,锌作阳极,铁作阴极,则a为锌电极,b为铁电极,电解质溶液可以是硫酸锌、氯化锌等锌的可溶性盐溶液,则装置图为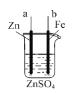 。
。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题.
周期 |
|
|
|
|
|
|
| 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)10种元素中,化学性质最不活泼的是_________.
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是_________.
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________.
(4)元素⑦的简单氢化物的化学式为_____;若该氢化物和元素⑨的单质反应,则化学方程式为_______.
(5)⑤和⑨的最高价氧化物对应水化物的化学式分别为_________和_________.
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式为__________________.