题目内容
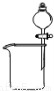
氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有
关性质。
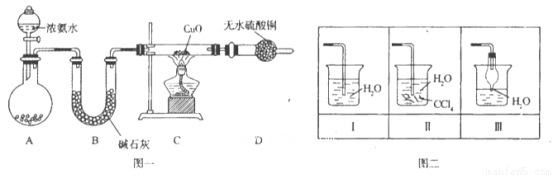
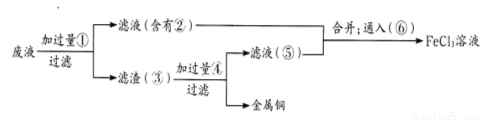
(1)装置A中烧瓶内试剂可选用__________(填序号)。B的作用是_______。
a.碱石灰 b.浓硫酸 C.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_______(填I或Ⅱ)。
I.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为__________________________________________________。 该反应证明氨气具有_________ 性。
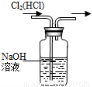
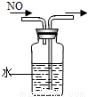
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_________(填装置序号)。
(5)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成0.5 L溶液,所得溶液的物质的量浓度为________________mol/L。
(1)ac;干燥氨气;(2)Ⅰ ; (3)3CuO+2NH3 3Cu+N2+3H2O;还原性;(4)Ⅱ、Ⅲ;(5)0.2mol/L。
3Cu+N2+3H2O;还原性;(4)Ⅱ、Ⅲ;(5)0.2mol/L。
【解析】
试题分析:本题考查氨气的制备和性质。(1)由题给装置图分析,装置A为氨气的发生装置,属于固液不加热制气体。a.碱石灰为氧化钙和氢氧化钠的混合物,浓氨水滴加到碱石灰上,会放出大量的热,浓氨水受热分解,产生氨气,正确,b.浓硫酸和氨水反应,不产生氨气,错误;c.生石灰和水反应放出大量热,能使氨水温度升高,促进氨水分解,正确;d.氨气极易溶于水,不能用烧碱溶液制取,错误;选ac;U形管B中装有碱石灰,其作用是干燥氨气;(2)连接好装置并检验装置的气密性后,装入药品,然后应先用氨气排尽装置中空气,应先打开旋塞逐滴向圆底烧瓶中加入氨水,选Ⅰ ; (3)根据题意知,氨气和氧化铜在加热条件下反应生成铜、氮气和水,化学方程式为3CuO+2NH3 3Cu+N2+3H2O;该反应中氮元素的化合价升高被氧化,证明氨气具有还原性;(4)该实验缺少尾气吸收装置,氨气极易溶于水,尾气吸收时要注意防倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ;(5)氨气极易溶于水,标准状况下,2.24 L氨气的物质的量为0.1mol,溶于水配成0.5 L溶液,所得溶液的物质的量浓度为0.2mol/L。
3Cu+N2+3H2O;该反应中氮元素的化合价升高被氧化,证明氨气具有还原性;(4)该实验缺少尾气吸收装置,氨气极易溶于水,尾气吸收时要注意防倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ;(5)氨气极易溶于水,标准状况下,2.24 L氨气的物质的量为0.1mol,溶于水配成0.5 L溶液,所得溶液的物质的量浓度为0.2mol/L。
考点:考查氨气的制备和性质。