题目内容
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是____________________
②反应最剧烈的烧杯是_______(填字母);
③写出b烧杯里发生反应的离子方程式_________________
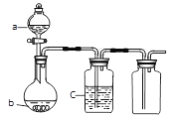
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:

填写所示仪器名称A___________B___________
(2)实验步骤: 连接仪器、________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是______________,装置E中足量酸性KMnO4溶液的作用是_______________。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________________;
③试管D中发生反应的离子方程式是_________________。
【答案】 验证锂、钠、钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强) c 2Na+2H2O=2Na++2OH-+H2↑ 分液漏斗 圆底烧瓶 检查装置的气密性 ![]() 除去SO2气体 盛有Na2SiO3溶液的试管中出现白色沉淀 SO2+2HCO3-=SO32-+H2O+CO2↑或SO2+HCO3-=HSO3-+CO2↑
除去SO2气体 盛有Na2SiO3溶液的试管中出现白色沉淀 SO2+2HCO3-=SO32-+H2O+CO2↑或SO2+HCO3-=HSO3-+CO2↑
【解析】试题分析:锂、钠、钾为ⅠA族金属元素,越活泼的金属越易与水反应,根据与水反应的难易验证金属性的强弱;铜与浓硫酸反应生成二氧化硫,由于亚硫酸的酸性大于碳酸,二氧化硫与碳酸氢钠溶液反应生成二氧化碳。要比较碳和硅两种元素的非金属强弱,通过二氧化碳通入硅酸钠溶液中制取硅酸验证;
解析:根据以上分析(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。可以根据与水反应的难易判断金属性的活泼性;①甲同学设计实验的目的是验证锂、钠、钾的活泼性;
②钾最活泼,反应最剧烈的烧杯是c;
③Na与水发生反应生成氢氧化钠和氢气的离子方程式2Na+2H2O=2Na++2OH-+H2↑;(Ⅱ)通过最高价氧化物对应水合物的酸性强弱来探究碳、硅元素的非金属性强弱,(1)仪器名称A是分液漏斗、B是圆底烧瓶;
(2)涉及到气体的实验,需连接仪器后检验装置气密性。
(3)①铜与浓硫酸反应生成硫酸铜、二氧化硫、水,化学方程式是![]() ;
;
为验证二氧化碳与硅酸钠反应生成硅酸沉淀,装置E中足量酸性KMnO4溶液的作用是除去CO2中SO2气体。
②碳酸的酸性大于硅酸,能说明碳元素的非金属性比硅元素非金属性强的实验现象是盛有Na2SiO3溶液的试管中出现白色沉淀;
③已知酸性,亚硫酸>碳酸,试管D中碳酸氢钠与二氧化硫反应生成二氧化碳,发生反应的离子方程式是SO2+2HCO3-=SO32-+H2O+CO2↑。

【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D