题目内容
7.焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如图:
已知:反应II包含2NaHSO3═Na2S2O5+H2O等多步反应.
(1)反应I的总化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应I进行时应先通入的气体是NH3,反应I产生的NH4Cl可用作氮肥.
(2)灼烧时发生反应的化学方程式为2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,若灼烧时生 成SO21.12×l06 L(标准状况下),则转移电子3×l05mol.
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52-+2H+=2SO2↑+H2O.
(4)副产品X的化学式是CuSO4•5H2O,在上述流程中可循环使用的物质是CO2.
(5)为了减少产品Na2S205中杂质含量,需控制反应II中气体与固体的物质的量之比约为2:1,检验产品中含有碳酸钠杂质所需试剂①④⑤.(填编号).
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸.
分析 反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5,
(1)根据流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠;反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;氯化铵常用作氮肥;
(2)CuS与氧气反应生成黑色氧化铜和二氧化硫气体,根据化学方程式可计算出转移电子的物质的量;
(3)Na2S2O5中硫元素的化合价为+4价,生成二氧化硫化合价没变;
(4)氧化铜与硫酸反应生成硫酸铜,结晶得出硫酸铜晶体;根据流程图可知,可循环使用的物质是二氧化碳;
(5)反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2 SO2+H2O=2NaHSO3+CO2,为了控制杂质,二氧化硫与碳酸氢钠应按反应方程式中比例关系反应;检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,据此答题.
解答 解:(1)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠,反应Ⅰ的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出,氯化铵常用作氮肥,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;NH3;氮肥;
(2)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,在该反应中每产生2mol二氧化硫则转移12mol电子,所以生成SO21.12×l06 L(标准状况下)即5×l04 mol,则转移电子3×l05 mol
故答案为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2;3×l05;
(3)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为:S2O52-+2H+=2SO2↑+H2O,
故答案为:S2O52-+2H+=2SO2↑+H2O;
(4)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4•5H2O,根据流程图可知,可循环使用的物质是CO2,
故答案为:CuSO4•5H2O;CO2;
(5)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用,反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为:2:1,检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,故选①④⑤,
故答案为:2:1;①④⑤.
点评 本题考查了物质置制备的实验方案分析,主要是物质性质的理解应用,离子方程式书写方法,注意试剂的选择和实验操作的目的,掌握基础是解题关键,题目难度中等.

| A. | 原子数之比为3:2 | B. | 同温同压下密度比是2:3 | ||
| C. | 同温同压下质量比是3:2 | D. | 标准状况下体积比是2:3 |
| A. | 漂白粉保存在密闭容器中 | B. | 新制氯水保存在棕色瓶中 | ||
| C. | AgBr保存在普通玻璃试剂瓶中 | D. | 往液溴中加少量水并密封保存 |
| A. | 13.6g | B. | 10.2g | C. | 6.8g | D. | 1.7g |
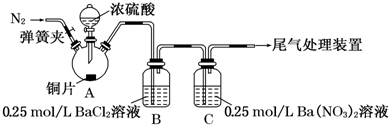
实验操作和现象:
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C 中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4(化学式).
(3)C溶液中发生的离子方程式为3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气
乙在A、B间增加洗气瓶D,D中盛放的试剂是浓硫酸或饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
| A. | Fe(OH)3胶体无色、透明,能产生丁达尔效应 | |
| B. | 硫酸溶液的导电性一定比醋酸溶液的导电性强 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | SO3溶于水后得到的溶液可以导电,但SO3是非电解质 |
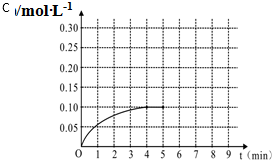 一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:

 (或
(或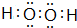
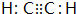 ).
).