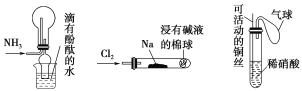
题目内容
【题目】甲、乙两种固体物质的溶解度曲线如图所示。
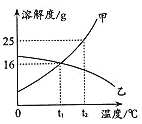
(1)t1℃时甲物质的溶解度是________g;乙物质的溶解度随温度升高而________(填“增大”或“减小”)。
(2)t2℃时甲物质的饱和溶液中溶质的质量分数为________;将t2℃时甲、乙两种物质的饱和溶液分别降温至t1℃,溶液中溶质质量分数大小关系是:甲______(填“<”、“=”或“>”)乙。
【答案】16g减少20%甲>乙
【解析】
(1)根据图像可知t1℃时甲物质的溶解度是16g,乙物质的溶解度随温度升高而减小。
(2)t2℃时甲物质的的溶解度是25g,其饱和溶液中溶质的质量分数为![]() ;将t2℃时甲、乙两种物质的饱和溶液分别降温至t1℃,甲物质的溶液仍然是饱和溶液,此时溶解度是16g。乙物质的溶解度随温度的升高而降低,降温后乙物质的溶液变为不饱和溶液。由于t2℃时乙物质的溶解度小于16g,所以溶液中溶质质量分数大小关系是甲>乙。
;将t2℃时甲、乙两种物质的饱和溶液分别降温至t1℃,甲物质的溶液仍然是饱和溶液,此时溶解度是16g。乙物质的溶解度随温度的升高而降低,降温后乙物质的溶液变为不饱和溶液。由于t2℃时乙物质的溶解度小于16g,所以溶液中溶质质量分数大小关系是甲>乙。

练习册系列答案
相关题目