题目内容
已知A、B、C、D、E为原子序数递增的五种短周期元素,A与C、B与D同主族.E是所在周期原子半径最小的元素,C、D质子数之和是A、B质子数之和的三倍,A元素某种同位素原子不含有中子.请根据以上信息回答:
(1)C2B2的电子式______,A2B2属于______晶体(“分子”、“原子”或“离子”).
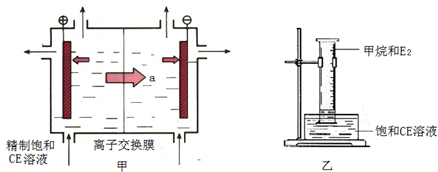
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是______,电解的离子方程式______.
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象______,你认为Fe丝在E2也可点燃的理由是______.
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有______种,水槽中的液体用饱和CE溶液而不用水的原因是______.
(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式______.
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是______.
(1)C2B2的电子式______,A2B2属于______晶体(“分子”、“原子”或“离子”).
(2)甲装置是离子交换膜法电解饱和CE溶液的原理示意图.透过交换膜的离子a是______,电解的离子方程式______.
(3)为检验E2的性质,某同学做了如下实验:
①Cu丝在E2中燃烧的现象______,你认为Fe丝在E2也可点燃的理由是______.
a.Fe与Cu都是金属元素
b.Fe的熔点比Cu高
c.Fe的密度比Cu小
d.Fe的金属性比Cu强
②将乙装置放置在光亮的地方(日光没有直接照射),一段时间后,观察到量筒壁上有油状液滴生成,量筒内气体颜色变浅等.生成的物质有______种,水槽中的液体用饱和CE溶液而不用水的原因是______.

(4)D的单质能跟C的最高价氧化物对应的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式______.
(5)用铂作电极电解1L含有0.4molCuDB4和0.2molCE的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是______.
(1)C2B2为过氧化钠,由钠离子与过氧根离子构成,电子数为
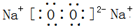
;
A2B2是过氧化氢,属于分子晶体.
故答案为:
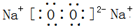
;分子.
(2)CE溶液为氯化钠溶液,左侧连接电源的正极,氯离子放电生成氯气,溶液含有过多的钠离子;右侧连接电源的负极
,氢离子放电生成氢气,溶液中含有过多的氢氧根,为使两侧溶液呈电中性,离子a从左侧透过交换膜到右侧,故离子a是Na+.电解的离子方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-.
故答案为:Na+;2Cl-+2H2O
Cl2↑+H2↑+2OH-.
(3)①E2是氯气,Cu丝在氯气中燃烧的现象为 产生棕黄色的烟;Cu丝在氯气能燃烧,Fe的金属性比Cu强,Fe丝在氯气中也可点燃燃烧.
故答案为:产生棕黄色的烟; d.
②E2是氯气,甲烷与氯气在光照条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢5种物质.
水槽中的液体用饱和氯化钠溶液目的是降低Cl2在水中的溶解度,抑制Cl2和水的反应.
故答案为:5;降低Cl2在水中的溶解度,抑制Cl2和水的反应.
(4)D的单质为S,C的最高价氧化物对应的水化物的浓溶液为氢氧化钠溶液,S与氢氧化钠溶液反应生成硫化钠、亚硫酸钠和水,离子方程式为3S+6OH-═2S2-+SO32-+3H2O.
发生氧化还原反应,
(5)CuDB4是硫酸铜,CE是氯化钠,电解含有0.4mol硫酸铜和0.2mol氯化钠的水溶液,阳离子为铜离子放电,阴离子先是氯离子放电生成氯气,氯离子提供的电子的物质的量为0.2mol,由于得到了0.3molCu,转移电子物质的量为0.6mol,所以氢氧根还放电生成氧气,氢氧根提供的电子的物质的量为0.6mol-0.2mol=0.4mol.
2Cl--2e-═Cl2↑
0.2mol 0.2mol 0.1mol
4OH--4e-═2H2O+O2↑
0.4mol 0.1mol
所以生成的气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L.
故答案为:4.48L.
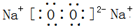
;
A2B2是过氧化氢,属于分子晶体.
故答案为:
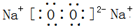
;分子.
(2)CE溶液为氯化钠溶液,左侧连接电源的正极,氯离子放电生成氯气,溶液含有过多的钠离子;右侧连接电源的负极
,氢离子放电生成氢气,溶液中含有过多的氢氧根,为使两侧溶液呈电中性,离子a从左侧透过交换膜到右侧,故离子a是Na+.电解的离子方程式为2Cl-+2H2O
| ||
故答案为:Na+;2Cl-+2H2O
| ||
(3)①E2是氯气,Cu丝在氯气中燃烧的现象为 产生棕黄色的烟;Cu丝在氯气能燃烧,Fe的金属性比Cu强,Fe丝在氯气中也可点燃燃烧.
故答案为:产生棕黄色的烟; d.
②E2是氯气,甲烷与氯气在光照条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢5种物质.
水槽中的液体用饱和氯化钠溶液目的是降低Cl2在水中的溶解度,抑制Cl2和水的反应.
故答案为:5;降低Cl2在水中的溶解度,抑制Cl2和水的反应.
(4)D的单质为S,C的最高价氧化物对应的水化物的浓溶液为氢氧化钠溶液,S与氢氧化钠溶液反应生成硫化钠、亚硫酸钠和水,离子方程式为3S+6OH-═2S2-+SO32-+3H2O.
发生氧化还原反应,
(5)CuDB4是硫酸铜,CE是氯化钠,电解含有0.4mol硫酸铜和0.2mol氯化钠的水溶液,阳离子为铜离子放电,阴离子先是氯离子放电生成氯气,氯离子提供的电子的物质的量为0.2mol,由于得到了0.3molCu,转移电子物质的量为0.6mol,所以氢氧根还放电生成氧气,氢氧根提供的电子的物质的量为0.6mol-0.2mol=0.4mol.
2Cl--2e-═Cl2↑
0.2mol 0.2mol 0.1mol
4OH--4e-═2H2O+O2↑
0.4mol 0.1mol
所以生成的气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L.
故答案为:4.48L.

练习册系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: