题目内容
【题目】如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.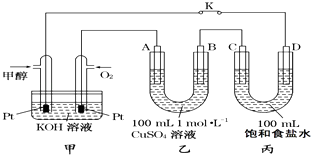
(1)甲中负极的电极反应式为 .
(2)乙中A极电极反应式为 , A极析出的气体在标准状况下的体积为 .
(3)丙装置溶液中C极的质量变化为 . 若在丙装置溶液中滴入酚酞溶液进行上述实验,D极附近能观察到的实验现象: .
【答案】
(1)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
(2)4OH﹣﹣4e﹣=2H2O+O2↑;2.24L
(3)12.8g;有气泡产生,D极附近溶液变红
【解析】解:(1.)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,所以答案是:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
(2.)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为x,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2+ | = | 2e﹣ | = | Cu | |||||
0.1mol | 0.2mol | ||||||||
2H+ | + | 2e﹣ | = | H2↑ | |||||
2x | x | ||||||||
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH﹣ | - | 4e﹣ | = | 2H2O | + | O2↑ |
4x | x |
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;2.24L;
(3.)C极与正极相连为阳极,Cu在阳极失电子生成铜离子,甲电池中消耗0.1mol氧气,转移电子为0.4mol,则丙中也转移0.4mol电子,由Cu﹣2e﹣=Cu2+可知参加反应的Cu为0.2mol,器质量为12.8g,即C极的质量变化为;D极为阴极,阴极上水得电子生成氢气和氢氧根离子,所以滴入酚酞溶液D极附近溶液变红;
所以答案是:12.8g;有气泡产生,D极附近溶液变红.