题目内容
【题目】某同学在总结元素化合物性质的过程中,发现化学反应无非是与以下几类物质的反应,并发现同一物质类别具有一定的通性。
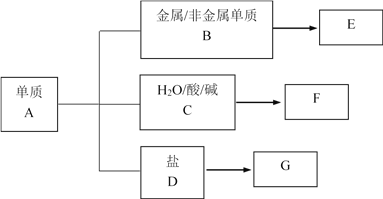
(1)若A由短周期金属元素组成,其最外层电子数比电子层数少2。
①组成A的元素在周期表中的位置是_______。
②下列说法正确的是_______(填字母)。
a. A的金属性在短周期元素中最强
b. F可能使酚酞溶液变红
c. A能从D溶液中置换出活泼性较弱的金属单质
(2)若A在通常情况下为黄绿色气体。
①若B为一种金属单质,则A与B反应的方程式为_______。(任举一例)
②若C为NaOH溶液,则与0.5 mol A反应转移电子数为_______mol。
【答案】 ① 第3周期 第IA族 a b 2Na+Cl2 ![]() 2NaCl(与Mg、Fe等反应也可) 0.5
2NaCl(与Mg、Fe等反应也可) 0.5
【解析】(1)A由短周期金属元素组成,其最外层电子数比电子层数少2,A为钠元素,①组成A的元素在周期表中的位置是第3周期 第IA族;②;a、钠的金属性在短周期元素中最强,故正确;b. 钠与水生成的碱或弱酸反应生成的强碱弱酸盐F呈碱性,F可能使酚酞溶液变红,故正确;c. 钠与盐的水溶液反应,钠先与水反应生成碱,不能从D溶液中置换出活泼性较弱的金属单质,故错误。故选ab。(2)若A在通常情况下为黄绿色气体,则A为氯气。①若B为一种金属单质,B可以为钠镁铁铜等金属,则A与B反应的方程式为2Na+ Cl2 ![]() 2NaCl(与Mg、Fe等反应也可)。(任举一例)②若C为NaOH溶液,氯气与氢氧化钠反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,每摩氯气反应,转移1摩电子,则与0.5 mol Cl2反应转移电子数为0.5mol。
2NaCl(与Mg、Fe等反应也可)。(任举一例)②若C为NaOH溶液,氯气与氢氧化钠反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,每摩氯气反应,转移1摩电子,则与0.5 mol Cl2反应转移电子数为0.5mol。

 轻松课堂单元期中期末专题冲刺100分系列答案
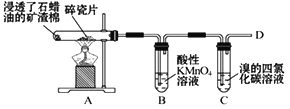
轻松课堂单元期中期末专题冲刺100分系列答案【题目】某实验小组为了探究SO2的性质,设计了如下装置,
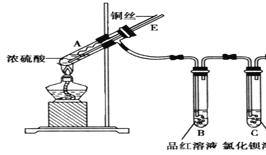
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管;
③将铜丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式是______。
(2)B试管中的现象是______。
(3)试管C无明显现象,某小组取一部分反应后的溶液,分别滴加以下试剂,请你预测能否生成沉淀,若生成沉淀,写出生成沉淀的化学式。
加入试剂 | 能否生成沉淀 | 沉淀的化学式 |
氯水 | _____________ | __________ |
氨水 | __________ | ___________ |