题目内容
10.Al(OH)3的电离方程式可表示为:H2O+AlO2-+H+═Al(OH)3═Al3++3OH-,试根据平衡移动原理解释下列有关问题:(1)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是加入氢氧根消耗氢离子,使得氢离子浓度降低,平衡向生成偏铝酸根的方向移动,使得氢氧化铝溶解
(2)向Al(OH)3沉淀中加入盐酸,沉淀溶解,有关的离子方程式是3H++Al(OH)3=3H2O+Al3+?
分析 (1)向Al(OH)3沉淀中加入苛性钠溶液抑制碱式电离,促进酸式电离得到偏铝酸钠溶液;
(2)向Al(OH)3沉淀中加入盐酸,抑制酸式电离,促进碱式电离生成氯化铝溶液.
解答 解:Al(OH)3的电离方程式可表示为:H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,存在酸式电离生成偏铝酸根离子,碱式电离生成铝离子,
(1)向Al(OH)3沉淀中加入苛性钠溶液抑制碱式电离,促进酸式电离得到偏铝酸钠溶液,沉淀溶解,
故答案为:加入氢氧根消耗氢离子,使得氢离子浓度降低,平衡向生成偏铝酸根的方向移动,使得氢氧化铝溶解;
(2)向Al(OH)3沉淀中加入盐酸,抑制酸式电离,促进碱式电离生成氯化铝溶液,沉淀溶解,反应的离子方程式为:3H++Al(OH)3=3H2O+Al3+,
故答案为:3H++Al(OH)3=3H2O+Al3+.
点评 本题考查了铝及其化合物性质的分析应用,主要是氢氧化铝两性的理解应,掌握氢氧化铝的两种电离平衡是解题关键,题目较简单.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
20.芳条结寒翠,请君添暖衣.深秋及寒冬的清晨,我们芜湖市经常出现大雾天气,雾中小液滴直径范围是( )
| A. | 小于1nm | B. | 在1~100nm间 | C. | 大于100nm | D. | 无法确定 |
1.将5.6g铁粉投入足量的100mL 2mol•L-1稀硫酸中,2min时铁刚好完全溶解.下列有关这个反应的速率表示正确的是( )
| A. | 铁的反应速率为0.5 mol•L-1•min-1 | |
| B. | 硫酸的反应速率为0.5 mol•L-1•min-1 | |
| C. | 硫酸亚铁的反应速率为0.25 mol•L-1•min-1 | |
| D. | 氢气的反应速率为0.5 mol•L-1•min-1 |
18.对食物的酸、碱性判断正确的是( )
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 鱿鱼、奶油是酸性食物 | D. | 大米、面包是碱性食物 |
5.下列实验操作中正确的是( )
| A. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| B. | 某固体加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- | |
| C. | 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热 |
2.最先发现电子的科学家是( )
| A. | 道尔顿 | B. | 玻尔 | C. | 汤姆生 | D. | 卢瑟福 |
19.将5mol/L的盐酸10mL稀释到100mL,再从中取出5mL,这5mL溶液的物质的量浓度为( )
| A. | 0.75 mol/L | B. | 0.25 mol/L | C. | 0.5 mol/L | D. | 1 mol/L |
20.标准状况下,若VL氢气含有的氢原子数为N,则阿伏加德罗常数可表示为( )
| A. | $\frac{22.4N}{V}$ mol-1 | B. | $\frac{VN}{22.4}$mol-1 | C. | $\frac{VN}{11.2}$ mol-1 | D. | $\frac{11.2N}{V}$ mol-1 |
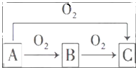 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):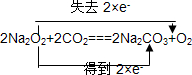 ,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为5.6L.如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为2Na2O2+Al3+═AlO2-+O2↑+4Na+.
,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为5.6L.如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为2Na2O2+Al3+═AlO2-+O2↑+4Na+.