题目内容
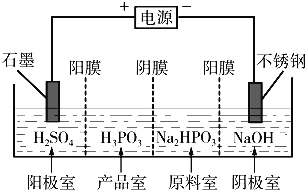
【题目】铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

(1)沉淀A、B的成分分别是__________、__________;步骤②中的试剂a是__________;(以上均填化学式)
(2)试写出步骤③中发生反应的离子方式__________、__________;
【答案】SiO2 Fe(OH)3 NaOH溶液 CO2 +OH- =HCO3- CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-
【解析】
铝土矿中加入过量试剂盐酸,然后过滤得到沉淀A为SiO2,滤液甲中加入过量NaOH溶液过滤后得到沉淀B和滤液乙,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝,以此解答该题。
(1)由以上分析可知A为SiO2,沉淀B为Fe(OH)3,滤液甲中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,步骤②中的试剂a是NaOH溶液;
(2)步骤③中与OH-反应生成碳酸氢根离子:CO2+OH-=HCO3-,偏铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,离子反应为:CO2 +AlO2- +2H2O=Al(OH)3↓+HCO3-。

【题目】为探究Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知:![]() (橙色)+ H2O
(橙色)+ H2O![]() (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
序号 | 操作 | 现象 |
i | 配制饱和Na2SO3 溶液,测溶液的pH | pH 约为 9 |
ii | 配制0.05 mol·L1 的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得到pH=2 的溶液A 和 pH=8 的溶液B | pH=2的溶液A 呈橙色;pH=8的溶液 B 呈黄色 |
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验iii 和 iv:
序号 | 操作 | 现象 |
iii | 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液变绿色(含Cr3+) |
iv | 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液没有明显变化 |
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验v:
序号 | 操作 | 现象 |
v | 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液A | 溶液变黄色 |
vi | 向 2 mL 蒸馏水中滴加 3 滴溶液A | 溶液变浅橙色 |
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
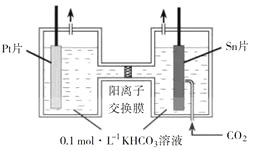
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
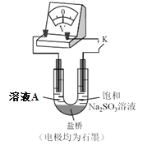
a.K 闭合时,电压为a。
b.向U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。