题目内容
在C(s)+H2O(g)?CO(g)+H2(g)△H>0中,采取下列措施,能使正反应速率增大的措施是( )
①缩小体积,增大压强 ②增加碳的量 ③恒容通入CO ④恒容充入N2 ⑤恒压充入N2⑥降低温度.
①缩小体积,增大压强 ②增加碳的量 ③恒容通入CO ④恒容充入N2 ⑤恒压充入N2⑥降低温度.
| A、①④ | B、②③⑤⑥ |
| C、①③ | D、①②④ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:反应是气体体积增大的吸热反应,依据化学平衡移动原理,改变条件,平衡向减弱这种改变的方向移动方向选项;
解答:
解:在C(s)+H2O(g)?CO(g)+H2(g)△H>0中,反应是气体体积增大的吸热反应,依据化学平衡移动原理分析
①缩小体积,增大压强,平衡向气体体积减小的方向进行,平衡逆向进行单正逆反应速率都增大,故①正确;
②碳为固体,增加碳的量对化学平衡无影响,故②错误;
③恒容通入CO,增大生成物浓度,平衡逆向进行,反应物浓度增大,正反应速率增大,故③正确;
④恒容充入N2 容器中总压强增大,气体分压不变,反应速率不变,平衡不变,故④错误;
⑤恒压充入N2 为保持恒压,体积增大,反应速率减小,故⑤错误;
⑥降低温度,正逆反应速率都减小,平衡向放热反应方向进行,故⑥错误;
故选C.
①缩小体积,增大压强,平衡向气体体积减小的方向进行,平衡逆向进行单正逆反应速率都增大,故①正确;
②碳为固体,增加碳的量对化学平衡无影响,故②错误;
③恒容通入CO,增大生成物浓度,平衡逆向进行,反应物浓度增大,正反应速率增大,故③正确;
④恒容充入N2 容器中总压强增大,气体分压不变,反应速率不变,平衡不变,故④错误;
⑤恒压充入N2 为保持恒压,体积增大,反应速率减小,故⑤错误;
⑥降低温度,正逆反应速率都减小,平衡向放热反应方向进行,故⑥错误;
故选C.
点评:本题考查了化学平衡影响因素分析判断,化学平衡移动原理的理解应用是解题关键,题目较简单.

练习册系列答案
相关题目
下列各组离子,在指定环境中一定能大量共存的是( )
| A、由水电离出的c(OH-)=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
| B、能使pH试纸变深蓝色的溶液中:Na+、S2-、SO32-、S2O32- |
| C、加入铝粉能放出氢气的溶液中:Mg2+、AlO2-、I-、NO3- |
| D、pH=7的溶液中:Al3+、K+、SO42-、HCO3- |
下列各组物质的燃烧热相等的是( )
| A、碳和二氧化碳 |
| B、1mol碳和3mol碳 |
| C、3mol乙炔(C2H2)和1mol苯 |
| D、淀粉和纤维素 |
在空气中放置,因发生氧化还原反应而变质的是( )
| A、Na |
| B、Na2O |
| C、Na2CO3 |
| D、NaOH |
下列物质的工业制备原理的方程式书写正确的是( )
| A、氢氧化钠:Na2CO3+Ca(OH)2→CaCO3↓+2NaOH | ||
B、乙醇:C6H12O6
| ||
C、二氧化硫:Cu+2H2SO4(浓)
| ||
D、氯气:Ca(ClO)2+4HCl(浓)
|
下列所用除杂的试剂和操作方法均正确的是( )
| 选项 | 物质 | 杂质 | 所用试剂 | 操作方法 |
| ① | 乙烯 | 二氧化硫 | 氯水 | 洗气 |
| ② | 乙炔 | 硫化氢 | 氢氧化钠溶液 | 洗气 |
| ③ | 苯 | 苯酚 | 溴水 | 过滤 |
| ④ | 溴苯 | 液溴 | 氢氧化钠溶液 | 分液 |
| A、②④ | B、①④ | C、②③ | D、①③ |
有机反应的类型很多,下列各反应中与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A、C2H5Cl→CH2═CH2 |
| B、CH3CHO→C2H5OH |
C、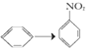 |
| D、CH3COOH→CH3COOC2H5 |
把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L?min),下列说法错误的是( )
| A、x=2 |
| B、B的转化率为20% |
| C、平衡时A的浓度为0.8mol/L |
| D、恒温达平衡时容器内的压强与开始时相等 |