题目内容
下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| C.根据盖斯定律,可计算某些难以直接测定的化学反应的反应焓变 |
D.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 不同 不同 |
C
A错,化学反应的基本特征是有新的物质产生,同时伴随着能量的变化,其能量的变化通常以热量的形式表现出来,有吸热反应,有放热反应,所以,生成物能量可能低于反应物总能量也可能高于反应物的总能量;B错,分子化分为原子时要吸收能量,反应之原子结合成分子时要释放能量,所以相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量;C正确;D错,同温同压下, 在光照和点燃条件的
在光照和点燃条件的 相同,同一化学反应的反应热是一个固定的值;
相同,同一化学反应的反应热是一个固定的值;
 在光照和点燃条件的
在光照和点燃条件的 相同,同一化学反应的反应热是一个固定的值;
相同,同一化学反应的反应热是一个固定的值;
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2HI(g),
2HI(g), CH3OH(g)
CH3OH(g)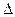 H1
H1 .2mol·L-1,则CO的转化率为 ,此时的温度
.2mol·L-1,则CO的转化率为 ,此时的温度 CH4(g)+3/2O2(g)
CH4(g)+3/2O2(g) l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)
l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)  T1℃时催化效率最高,能使正反应速率加快约3×105倍;
T1℃时催化效率最高,能使正反应速率加快约3×105倍; CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1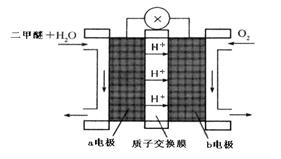
 回收,并填埋处理
回收,并填埋处理