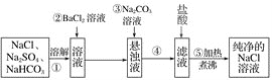
题目内容
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
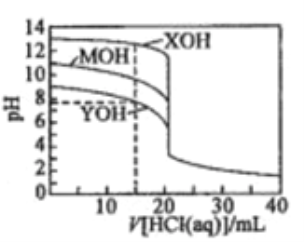
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
【答案】C
【解析】由图示,0.1000mol/L的三种一元碱XOH、MOH、YOH溶液的pH分别为13、11、9,说明XOH完全电离,所以XOH为强碱,MOH、YOH都电离一部分,所以MOH、YOH均为弱碱,选项A正确。以XOH溶液为例,V[HCl(aq)]=15.00mL时,此溶液存在电荷守恒:c(H+) +c(X+)=c(Cl-)+c(OH-),所以溶液的离子总浓度为2[c(Cl-)+c(OH-)]。三个溶液都可以重复如上计算,得到三个溶液的离子总浓度都是2[c(Cl-)+c(OH-)],因为加入的HCl溶液的体积相等,所以三个溶液的c(Cl-),只需要比较c(OH-)即可。由图示,V[HCl(aq)]=15.00mL时,三种溶液的pH大小顺序为:XOH>MOH>YOH,pH越高代表c(OH-)越大,所以V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序为XOH>MOH>YOH,选项B正确。V[HCl(aq)]=20.00mL时,加入的HCl与三种碱都完全中和,得到盐溶液。因为XOH是强酸,所以中和得到强酸强碱盐,不水解,所以对于水的电离应该无影响,而另两个碱都是弱碱,中和生成的盐都水解,对于水的电离产生促进作用,所以V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度是XOH最小,选项C错误。V[HCl(aq)]=40.00ml.时,得到HCl和YCl浓度相等的混合溶液,有电荷守恒:c(H+) +c(Y+)=c(Cl-)+c(OH-),与题目选项D的等式联立,化简得到:c(Cl-)=2c(Y+)+2c(YOH),这是该溶液的物料守恒,所以说明选项D中的等式正确,即选项D正确。

【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
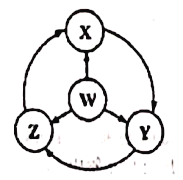
选项 | W | X | Y | Z |
A | Fe | Fe(OH)2 | FeCl3 | FeCl2 |
B | Na | Na202 | NaOH | NaCl |
C | S | SO2 | SO3 | H2SO4 |
D | A1 | AlCl3 | NaAlO2 | Al2(SO4)3 |
A. A B. B C. C D. D