题目内容
【题目】常温下,用0.100 0 mol/L NaOH溶液分别滴定20.00 mL 0.100 0 mol/L盐酸和20.00 mL 0.100 0 mol/L醋酸溶液,得到2条滴定曲线,如图所示。
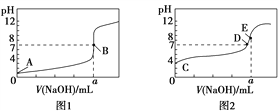
若以HA表示酸,下列说法不正确的是
A. 滴定盐酸的曲线是图1
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)=n(HCl)
D. 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】D
【解析】A、滴定起点0.1000mol·L-1盐酸pH=1,0.1000mol·L-1醋酸pH>1,滴定盐酸的曲线是图1,故A正确;B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;C、达到B、E状态时,反应消耗的氢氧化钠物质的量是相等的,由反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故C正确;D、当0mL<V(NaOH)<20.00mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,c(H+)>c(Na+),应为c(A-)>c(H+)>c(Na+)>c(OH-),故D错误。故选D。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目