题目内容
7.工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).(1)实验原理:①Al4C3与硫酸反应可生成CH4.②AlN溶于强酸产生铵盐,溶于强碱生成氨气.
(2)实验装置(如图所示):
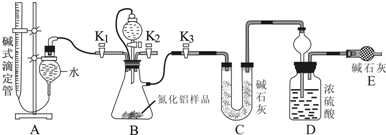
(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL.②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应.③待反应进行完全后,关闭活塞K1,打开活塞K3、打开K2,通过分液漏斗加入过量NaOH,与装置B瓶内物质充分反应.④通入空气一段时间 (填入该步应进行的操作).⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L•mol-1)
①Al4C3的质量分数为$\frac{0.048(a-b)}{{V}_{m}x}$×100%.
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积偏小(填“偏大”、“偏小”或“无影响”).
③AlN的质量分数为$\frac{41(z-y)}{17x}$×100%.
分析 (3)实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.
①、通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1.
②、③、用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,故应关闭活塞K1,打开活塞K3.
④装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收.
(4)数据分析:
①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数.
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
③根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,可求得Al4C3的质量分数.
解答 解:(3)实验过程:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.
通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,故应关闭活塞K2、K3,打开活塞 K1.用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数.故应关闭活塞K1,打开活塞K3由②中分析可知,通过分液漏斗加入过量氢氧化钠溶液,装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小.
故答案为:K3、打开K2,通入空气一段时间;
(4)数据分析:
①甲烷的体积为(a-b)mL,物质的量为 $\frac{(a-b)×1{0}^{-3}L}{Vml/mol}$=$\frac{a-b}{{V}_{m}}$×10-3mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为 $\frac{1}{3}$×$\frac{a-b}{{V}_{m}}$×10-3mol×144g/mol=$\frac{48(a-b)}{{V}_{m}}$×10-3g,Al4C3的质量分数为 $\frac{\frac{48(a-b)}{{V}_{m}}×1{0}^{-3}g}{xg}$×100%=$\frac{0.048(a-b)}{{V}_{m}x}$×100%.
故答案为:$\frac{0.048(a-b)}{{V}_{m}x}$×100%.
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
故答案为:偏小.
③氨气的质量为(z-y)g,物质的量为 $\frac{(z-y)g}{17g/mol}$=$\frac{z-y}{17}$mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为 $\frac{z-y}{17}$mol×41g/mol=$\frac{41(z-y)}{17}$g,故AlN的质量分数为 $\frac{41(z-y)}{17x}$×100%,
故答案为:$\frac{41(z-y)}{17x}$×100%.
点评 考查对实验原理与操作步骤的理解、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.

| A. | v(A)=0.3mol•L-1•min-1 | B. | v(B)=0.6mol•L-1•min-1 | ||
| C. | v(C)=0.5mol•L-1•min-1 | D. | v(D)=0.001mol•L-1•min-1 |
| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3 NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 5.6 g铁粉在足量的氯气中充分燃烧,得到电子数为0.3 NA |
| A. | 在大力推广乙醇汽油的同时,研究开发太阳能电池和氢燃料电池汽车 | |
| B. | 大力发展农村沼气,将废弃的农作物秸秆转化为清洁、高效的能源 | |
| C. | 研发高效低毒农药,降低蔬菜的农药残留量 | |
| D. | 以聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材的使用,保护森林 |
| A. | 根据酸分子中含有的氢原子个数、将酸分为一元酸、二元酸和多元酸 | |
| B. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| C. | 铝热剂、福尔马林、水玻璃、漂白粉均为混合物 | |
| D. | 明矾、水银、烧碱、硫酸均为强电解质 |
| A. | 电解饱和食盐水可制取烧碱、氯气、氢气 | |
| B. | 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ | |
| C. | 以海水为原料可提取镁、溴、碘等物质 | |
| D. | 在镀件上镀铜,镀件作阴极 |