��Ŀ����
����Ŀ������Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո�
��1�������ڷŵ�ʱ��ԭ������ã��ڳ��ʱ����ص����ã�Ǧ�����ڷŵ�ʱ�����ĵ�ط�ӦʽΪ�� ��
��2��FeCl3��Һ�����ڸ�ʴӡˢ��·ͭ�壬����2FeCl3+Cu�T2FeCl2+CuCl2 �� �����˷�Ӧ��Ƴ�ԭ��أ������õ缫����Ϊ �� ����·��ת��0.2mol����ʱ����ʴͭ������Ϊg
��3������Ƭ��ͭƬ�õ���������һ�����Ũ�����У�һ������ռ���Һ�У��ֱ��γ���ԭ��أ���������ԭ����У������ֱ�Ϊ ��
A.��Ƭ��ͭƬ
B.ͭƬ����Ƭ
C.��Ƭ����Ƭ
��4��ȼ�ϵ����һ�ָ�Ч�������ѺõĹ���װ�ã���ͼ�Ǽ���ȼ�ϵ��ԭ��ʾ��ͼ�� 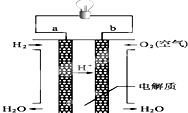
�ش��������⣺
������ȼ�ϵ�ص��ܷ�Ӧ��ѧʽ�ǣ� ��
�ڵ�ع���һ��ʱ���������Һ��pH�����������С�����䡱����
���𰸡�
��1��Pb+PbO2+2H2SO4=2PbSO4+2H2O
��2��Cu��6.4
��3��B
��4��2H2+O2=2H2O������
���������⣺��1���ŵ�ʱ��������PbO2�õ��ӣ�������ӦʽΪPbO2+4H++SO42��+2e���TPbSO4+2H2O��������Pbʧ���ӣ�Pb+SO42����2e���TPbSO4 �� �ܷ�ӦΪ��Pb+PbO2+2H2SO4=2PbSO4+2H2O�� ���Դ��ǣ�Pb+PbO2+2H2SO4=2PbSO4+2H2O����2���õ�ط�Ӧ�У�ͭʧ���ӷ���������Ӧ����������������ӦʽΪCu��2e��=Cu2+ �� ����·��ת��0.2mol����ʱ����Ӧ��CuΪ0.1mol��������Ϊ6.4g��
���Դ��ǣ�Cu��6.4����3����Ƭ��ͭƬ����ŨHNO3��Һ�У���������ۻ�������ͭ��Ũ����֮��ᷢ���Է���������ԭ��Ӧ����ʱ����ͭʱ��������������������
����ϡNaOH��Һ�У�����ͭ��������Ӧ���������ܺ��������Ʒ����Է���������ԭ��Ӧ����ʱ�������Ǹ���������ͭ��������
���Դ��ǣ�B����4��������ȼ�ϵ�ص��ܷ�Ӧ����������������Ӧ����ˮ���䷴Ӧ���ܷ���ʽΪ��2H2+O2=2H2O��
���Դ��ǣ�2H2+O2=2H2O������֪����ȼ�ϵ�ص��ܷ�ӦΪ��2H2+O2=2H2O����ع���һ��ʱ�������ˮʹ��Һ��������������Ũ�ȼ�С��pH����
���Դ��ǣ�����
