题目内容
【题目】在KClO3+6HCl=KCl+3Cl2↑+3H2O反应中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为( )
A.6:1B.5:1C.1:3D.1:5
【答案】B
【解析】
根据“只靠拢、不交叉”原则,Cl元素的化合价由KClO3中的+5价降至Cl2中的0价,Cl2为还原产物,1molKClO3得到5mol电子生成0.5molCl2;Cl元素的化合价由HCl中的-1价升至Cl2中的0价,Cl2为氧化产物,1molHCl失去1mol电子生成0.5molCl2;根据得失电子相等,氧化产物和还原产物物质的量之比为5:1,答案选B。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5﹣3 | +7﹣1 | +6﹣2 | +3 |
(1)Z离子的结构示意图为 .
(2)关于Y、Z两种元素,下列叙述正确的是(填序号). a.简单离子的半径 Y>Z
b.气态氢化物的稳定性Y比 Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e﹣分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是 . 一段时间后,观察到试管中的现象是 , 发生反应的离子方程式是 . 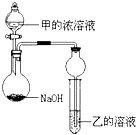
(4)T,X两种元素形成XT5固体,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则其电子式为 .
(5)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为 .
(6)常温下,Z2Y2是一种橙黄色液体,广泛用于橡胶工业的硫化机,其分子结构与双氧水分子相似.试写出其结构式