题目内容
【题目】下列反应所得产物一定不存在同分异构体的是
A. 2-丁烯与HCl反应
B. 2-氯丁烷(![]() )与NaOH乙醇溶液共热
)与NaOH乙醇溶液共热
C. 甲苯与Cl2在一定条件下发生取代反应
D. 异戊二烯(![]() )与等物质的量的Br2反应
)与等物质的量的Br2反应
【答案】A
【解析】分析:A、根据2-丁烯与HCl反应的生成物判断;
B、根据2-氯丁烷与NaOH乙醇溶液共热发生消去反应的生成物判断;
C、根据甲苯中存在4种不同的氢原子分析;
D、根据二烯烃与溴可发生1,2-加成或1,4-加成来判断。
详解:A、2-丁烯与HCl反应的生成物只有2-氯丁烷,不存在同分异构体,A正确;
B、2-氯丁烷与NaOH乙醇溶液共热发生消去反应可生成1-丁烯或2-丁烯,则存在同分异构体,B错误;
C、甲苯在一定条件下与氯气反应,可取代甲基上的氢原子,也可能取代苯环上的氢原子,存在同分异构体,C错误;
D、异戊二烯与溴可发生1,2-加成生成2种物质,发生1,4-加成生成1种物质,存在同分异构体,D错误;答案选A。

【题目】表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10﹣10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | ﹣ | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | ﹣2 | ﹣ | ﹣2 | ﹣ | ﹣4 | ﹣3 | ﹣1 | ﹣ | ﹣3 | ﹣4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第____________,其基态原子的核外电子排布式是___________.
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)______.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成σ键与π键之比_________;I与氢元素形成的10电子分子X的空间构型为_____。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为___________ 。
(5)如图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_______________
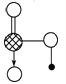
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为___,若晶胞边长为a pm,则晶体的密度为(用含a、NA的代数式表示)________________(g/mL)。