题目内容
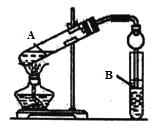
【题目】SnCl4可用于染色时的媒染剂、润滑油添加剂、玻璃表面处理剂等。实验室可以通过如下图装置制备少量SnCl4(夹持装置略)。

已知:①锡的熔点232℃、沸点2 260℃;②SnCl2的熔点246.8℃、沸点623℃;③SnCl4的熔点-33℃、沸点114℃,SnCl4极易水解。通常将SnCl4晶体加入浓盐酸中,以配制无色的SnCl4溶液。
回答下列问题:
(1)仪器a的名称为_________,该仪器中发生反应的离子方程式为_________。
(2)装置Ⅱ的作用是___________,如果去掉装置Ⅱ,从实验安全的角度看可能产生的影响是____________。
(3)装置Ⅲ中的试剂为____________。下图中可替代装置Ⅲ的是__________(填字母序号,下同)

(4)该实验装置存在一处明显的缺陷,改进方法为在装置Ⅵ后连接上图中的_________。
(5)若反应中消耗17.85 g锡粉可得到37.2 gSnCl4,则SnCl4的产率为________。(保留3位有效数字)。
(6)作为变价金属的高价离子,Sn4+和Fe3+均有氧化性。请设计实验验证Sn4+和Fe3+的氧化性强弱_________。
【答案】圆底烧瓶 MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O 除去氯气中的氯化氢 锡与氯化氢反应产生的氢气会与氯气混合加热发生爆炸 浓硫酸 C D 95.0% 取少量上述溶液,滴加氯化亚铁溶液,充分振荡后再滴加硫氰化钾溶液,若溶液变红,说明Sn4+氧化性比Fe3+强;反之则说明Sn4+氧化性比Fe3+弱
Cl2↑+Mn2++2H2O 除去氯气中的氯化氢 锡与氯化氢反应产生的氢气会与氯气混合加热发生爆炸 浓硫酸 C D 95.0% 取少量上述溶液,滴加氯化亚铁溶液,充分振荡后再滴加硫氰化钾溶液,若溶液变红,说明Sn4+氧化性比Fe3+强;反之则说明Sn4+氧化性比Fe3+弱
【解析】
由装置可知:装置I应为制备氯气的装置,涉及离子反应为MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O;装置Ⅱ中为饱和食盐水;装置Ⅲ中为浓硫酸,氯气经过除杂干燥后,与锡发生反应生成四氯化锡,经冷却后在装置Ⅵ中收集,因四氯化锡极易水解,应防止空气中的水蒸气进入装置Ⅵ中;据以上分析解答。
Cl2↑+Mn2++2H2O;装置Ⅱ中为饱和食盐水;装置Ⅲ中为浓硫酸,氯气经过除杂干燥后,与锡发生反应生成四氯化锡,经冷却后在装置Ⅵ中收集,因四氯化锡极易水解,应防止空气中的水蒸气进入装置Ⅵ中;据以上分析解答。
(1)仪器a为圆底烧瓶;二氧化锰与浓盐酸加热反应生成氯气和氯化锰和水,离子方程式为MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O;综上所述,本题答案是:圆底烧瓶;MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O;综上所述,本题答案是:圆底烧瓶;MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O。
Cl2↑+Mn2++2H2O。
(2)由于盐酸具有挥发性,所以在制取的氯气中含有杂质氯化氢,在与金属锡反应前要除去,因此装置Ⅱ中的试剂既可以除去氯化氢同时还可以减小氯气的消耗,选用饱和食盐水;如果去掉装置Ⅱ,锡与氯化氢反应产生的氢气会与氯气混合加热发生爆炸;综上所述,本题答案是:除去氯气中的氯化氢,锡与氯化氢反应产生的氢气会与氯气混合加热发生爆炸。
(3) 装置Ⅱ中的饱和食盐水,吸收了氯化氢,装置Ⅲ中的试剂为浓硫酸,吸收水蒸气,得到干燥的纯净的氯气;氯气能够与氢氧化钠、碱石灰反应,不能替代;硫酸为液体,虽然能干燥氯气,但是氯气不能通过硫酸溶液,形成通路,不能替代,氯化钙为固体干燥剂,气体能够通过,达到干燥的目的,选C;综上所述,本题答案是:浓硫酸;C。
(4) 四氯化锡易发生水解,为防止水解,要防止空气中的水蒸气进入装置Ⅵ,同时未反应的氯气会污染空气,所以改进措施为在装置Ⅵ后连接上盛有碱石灰的干燥管,选D。综上所述,本题选D。
(5)若反应中消耗17.85 g锡粉,则锡的物质的量为17.85/119=0.15mol,理论上生成四氯化锡的质量为:0.15×261=39.15 g,则SnCl4的产率为37.2/39.15×100%=95.0%;综上所述,本题答案是:95.0%。
(6) 要验证Sn4+和Fe3+氧化性强弱,可以取少量上述溶液,滴加氯化亚铁溶液,充分振荡后再滴加硫氰化钾溶液,若溶液变红,说明Sn4+氧化性比Fe3+强;反之则说明Sn4+氧化性比Fe3+弱;综上所述,本题答案是:取少量上述溶液,滴加氯化亚铁溶液,充分振荡后再滴加硫氰化钾溶液,若溶液变红,说明Sn4+氧化性比Fe3+强;反之则说明Sn4+氧化性比Fe3+弱。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案