题目内容
2.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、N03- | |
| B. | pH为11的溶液:S2-、SO32-、SO42-、Na+ | |
| C. | 水电离出来的c (H+)=10-13 mol/L的溶液:K+、HCO3一、Br一、Ba2+ | |
| D. | 无色溶液:K+、CO32-、N03-、Ca2+ |
分析 A.滴加石蕊试液显红色的溶液,显酸性,离子之间发生氧化还原反应;
B.pH为11的溶液,显碱性;
C.水电离出来的c (H+)=10-13 mol/L的溶液,为酸或碱溶液;
D.离子之间结合生成沉淀.
解答 解:A.滴加石蕊试液显红色的溶液,显酸性,Fe2+、H+、N03-发生氧化还原反应,不能大量共存,故A错误;
B.pH为11的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.水电离出来的c (H+)=10-13 mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在HCO3-,碱溶液中HCO3-、OH-、Ba2+结合生成沉淀和水,故C错误;
D.CO32-、Ca2+结合生成沉淀,不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
12.与50mL 0.1mol•L-1Na2CO3溶液中 Na+ 的物质的量浓度相同的溶液是( )
| A. | 50mL 0.2mol•L-1 的 NaCl 溶液 | |
| B. | 100mL 0.1mol•L-1 的 NaCl 溶液 | |
| C. | 25mL 0.2mol•L-1 的 Na2SO4 溶液 | |
| D. | 10mL 0.5mol•L-1 的 Na2CO3 溶液 |
13.下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式表示的是( )
| A. | FeBr2与Cl2 | B. | Ba(OH)2与H2SO4 | C. | HCl与Na2CO3 | D. | Ca(HCO3)2与NaOH |
10.下列有关化学用语使用正确的是( )
| A. | 硫离子(S2?)结构示意图: | |
| B. | NH4Cl的电子式: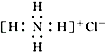 | |
| C. | 原子核内有8个质子、10个中子的氧原子:${\;}_{8}^{10}$O | |
| D. | H、D、T互为同素异形体 |
14.三种气态烃混合物VmL和足量氧气混合后,经点燃爆炸并恢复到原状况,体积共缩小2VmL,若所有气体体积均在25℃,101kPa下测定,则三种烃的组合不可能是( )
| A. | CH4 C2H4 C3H4 | B. | CH4 C2H6 C2H2 | C. | C2H2 C2H4 C3H4 | D. | C2H2C3H6 C4H8 |
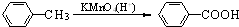
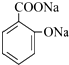
 (苯胺,易被氧化)
(苯胺,易被氧化)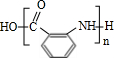 .
. 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: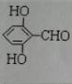 、
、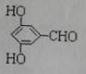 .
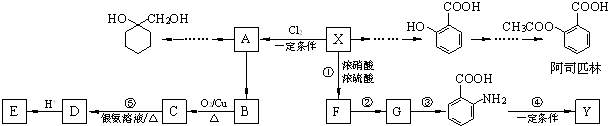
.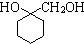 的流程图:
的流程图:
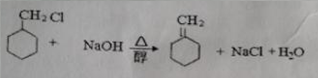 .
.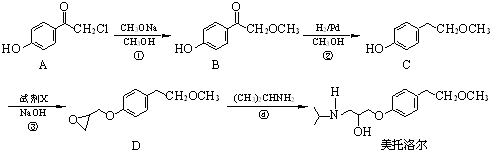
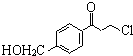 为原料
为原料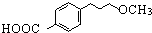 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
 ;
; 、-CHO;③的反应类型为加成反应(或还原反应).
、-CHO;③的反应类型为加成反应(或还原反应).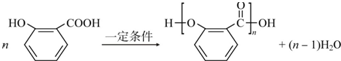 .
.