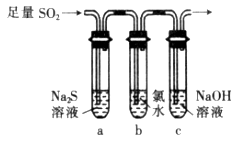
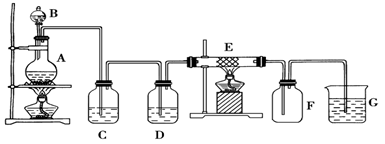
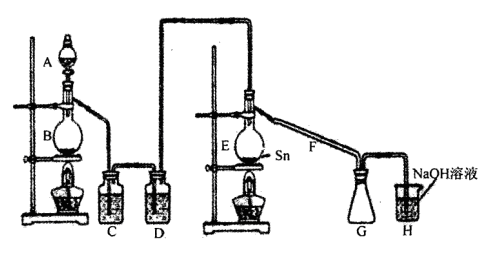
题目内容
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题: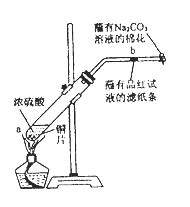
(1)写出a处反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈 色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是 ,反应的化学方程式为 。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”) 0.9 mol 。
(1)Cu+2H2SO4(浓)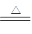 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(2)品红褪色(或者变浅) 滤纸变红(恢复红色)
(3)蓝色
(4)吸收二氧化硫,防止污染 Na2CO3+SO2=Na2SO3+CO2
(5)小于
解析试题分析:(1)浓硫酸具有强氧化性,能和铜反应,所以a处反应的化学方程式是Cu+2H2SO4(浓)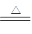 CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。
(2)SO2具有漂泊性,能使品红溶液褪色,所以试管中的液体反应一段时间后,b处滤纸条的变化为品红褪色(或者变浅);由于SO2的漂白是不稳定的,因此加热时又恢复到原来的颜色,即滤纸变红(恢复红色)。
(3)浓硫酸的密度大于水的,即上层水硫酸,下层是生成的硫酸铜,溶于水显蓝色。
(4)SO2是大气污染物,并能随意排放,则玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是吸收二氧化硫,防止污染,有关的方程式是Na2CO3+SO2=Na2SO3+CO2。
(5)由于在反应过程中,硫酸的浓度是逐渐降低的,而稀硫酸和铜不反应。硫酸的物质的量是1.8mol,则根据反应的化学方程式可知,被还原的硫酸小于0.9mol。
考点:本题考查铜和浓硫酸的反应、SO2性质的检验以及尾气处理和有关氧化还原反应的计算。

 阅读快车系列答案
阅读快车系列答案某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
| 实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
| Ⅰ | 6.4 | | | 假设1成立 |
| Ⅱ | 6.4 | 2.88 | 224 | |
| Ⅲ | 6.4 | 2.56 | 448 | |
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| | 酸 | 实验结果 |
| a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
| b | 稀硫酸 | 加热也不发生反应 |
| c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
| d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式:
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:

(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程:
工业上常用铁质容器盛装冷浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.10 mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有 气体。
【实验探究】
| | 实验操作 | 预期现象 | 结 论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液中 | | |
| 步骤②: | | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | | 含有两种或以上气体 |

【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行,并说明原因: 。
(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如下图(图中夹持仪器省略)。

①Q产生的原因是 (用化学方程式表示)。
②为确认Q的存在,则M中盛放的试剂为 ,并将装置M添加于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图中D、E、F组合的作用是 。