题目内容
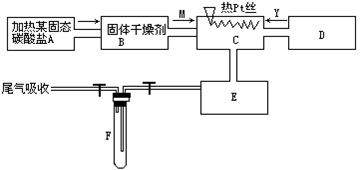
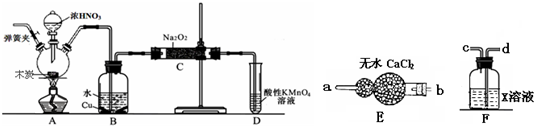
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略).(在木炭和浓硝酸反应之前已排尽装置中的空气)
已知:室温下,①2NO+Na2O2═2NaNO2②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO3-反应生成NO3-和Mn2+
(1)写出浓硝酸与木炭反应的化学方程式______.
(2)B中观察到的主要现象是______,D装置的作用是______.
(3)检验C中产物有亚硝酸钠的方法是______.
(3)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______.为避免产生这些副产物,应在B、C装置间增加装置E、F,则B中导管与E、F装置中导管接口的连接顺序是______.
已知:室温下,①2NO+Na2O2═2NaNO2②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO3-反应生成NO3-和Mn2+

(1)写出浓硝酸与木炭反应的化学方程式______.
(2)B中观察到的主要现象是______,D装置的作用是______.
(3)检验C中产物有亚硝酸钠的方法是______.
(3)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______.为避免产生这些副产物,应在B、C装置间增加装置E、F,则B中导管与E、F装置中导管接口的连接顺序是______.
(u)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(2)装置2中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管k有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管k有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在2、C装置间增加装置E、F,依次除去二氧化碳和水蒸气,则2中导管与E、F装置中导管接k的连接顺序是dc2a.故答案为:氢氧化钠;dc2a.
| ||
| &n2sp; |
故答案为:C+4HNO3(浓)
| ||
| &n2sp; |
(2)装置2中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管k有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管k有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在2、C装置间增加装置E、F,依次除去二氧化碳和水蒸气,则2中导管与E、F装置中导管接k的连接顺序是dc2a.故答案为:氢氧化钠;dc2a.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目