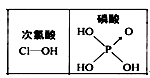
题目内容
下列分子中,杂化类型相同,空间构型也相同的是( )
| A.H2O、SO2 | B.BeCl2、CO2 | C.H2O、NH3 | D.NH3、CH2O |
B
试题分析:根据价层电子对互斥理论可知,水中O原子含有的孤对电子对数=(6-2×1)÷2=2,采取 sp3杂化方式,水是V型结构。SO2中S原子含有的孤对电子对数=(6-2×2)÷1,采取 sp2杂化方式,SO2是V形结构,故A不正确;同样分析氯化铍中Be原子是sp杂化,是直线型结构。CO2是直线型结构,碳原子是sp杂化,B正确;氨气中氮原子是sp3杂化,含有1对孤对电子,因此氨气是三角锥形结构,C不正确;甲醛中碳原子是sp2杂化,属于平面型结构,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查学生对价层电子对互斥理论和杂化轨道理论的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力。判断中心原子含有的孤对电子是答题的关键。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目

 )中存在一个手性碳原子,导致该物质存在互为镜像的两个
)中存在一个手性碳原子,导致该物质存在互为镜像的两个