题目内容
【题目】向某密闭容器中加入0.30![]()
![]() 、0.10
、0.10![]()
![]() 和一定量的
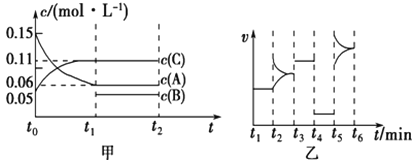
和一定量的![]() 三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[
三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[![]() 阶段的
阶段的![]() 变化未画出]。乙图为
变化未画出]。乙图为![]() 时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,
时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同, ![]() 阶段为使用催化剂。下列说法不正确的是
阶段为使用催化剂。下列说法不正确的是
A. 若![]() ,则用
,则用![]() 的浓度变化表示的
的浓度变化表示的![]() 阶段的平均反应速率为0.004
阶段的平均反应速率为0.004![]()
B. ![]() 阶段改变的条件一定为减小压强
阶段改变的条件一定为减小压强
C. 若该容器的容积为2![]() ,则
,则![]() 的起始的物质的量为0.02
的起始的物质的量为0.02![]()
D. 若![]() 阶段,容器内
阶段,容器内![]() 的物质的量减少了0.03
的物质的量减少了0.03![]() ,而此过程中容器与外界的热交换总量为
,而此过程中容器与外界的热交换总量为![]() ,则该反应的热化学方程式为:
,则该反应的热化学方程式为: ![]()
![]()
![]()
【答案】C
【解析】由图乙可知,t3~t4阶段为使用催化剂,t4~t5阶段改变条件平衡不移动,改变温度或某一组分浓度,平衡发生移动,故t4时改变的条件为减小压强,说明反应前后气体的体积相等,且反应速率减小,应是降低压强.t5时正逆反应速率都增大,应是升高温度,t2时正、逆反应速率中只有其中一个增大,应是改变某一物质的浓度;由图甲可知,t1时到达平衡,△c(A)=0.09mol/L,△c(C)=0.06mol/L,二者化学计量数之比为0.09:0.06=3:2,则B为生成物,反应方程式为:3A(g)B(g)+2C(g)。
A.若t1=15 s,t0~t1段△c(A)=0.9mol/L,则v(A)=![]() =0.006mol/(L.s),故A错误;B.根据上述分析,t4~t5阶段改变的条件是降低压强,故B错误;C.由3A (g)2C(g)+B(g)可知△c(B)=
=0.006mol/(L.s),故A错误;B.根据上述分析,t4~t5阶段改变的条件是降低压强,故B错误;C.由3A (g)2C(g)+B(g)可知△c(B)=![]() △c(C)=0.03mol/L,B的起始浓度=0.05mol/L-0.03mol/L=0.02mol/L,该容器的容积为2 L,B的起始物质的量为2L×0.02mol/L=0.02 mol,故C正确;D.t5~t6阶段为升高温度,容器内A的物质的量减少了0.06 mol,说明平衡正向移动,正反应为吸热反应,应是升高温度,3mol A反应放出的吸收的热量为akJ×
△c(C)=0.03mol/L,B的起始浓度=0.05mol/L-0.03mol/L=0.02mol/L,该容器的容积为2 L,B的起始物质的量为2L×0.02mol/L=0.02 mol,故C正确;D.t5~t6阶段为升高温度,容器内A的物质的量减少了0.06 mol,说明平衡正向移动,正反应为吸热反应,应是升高温度,3mol A反应放出的吸收的热量为akJ×![]() =50kJ,反应热化学方程式为:3A (g)2C(g)+B(g) △H=+50akJ/mol,故D错误;故选C。
=50kJ,反应热化学方程式为:3A (g)2C(g)+B(g) △H=+50akJ/mol,故D错误;故选C。

【题目】国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2 852 | 714 |
A. 宇航员喝茶时注入的H2O的摩尔质量是18克
B. H2O+Cl2![]() HCl+HClO这反应属于氧化还原反应
HCl+HClO这反应属于氧化还原反应
C. 氢的三种同位素1H、2D、3T与16O只能形成三种水分子
D. 在标准状况下,1mol水的体积约是22.4L