题目内容
工业生产中产生的含SO2废气经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等,以下是工业利用硫酸钙的部分流程: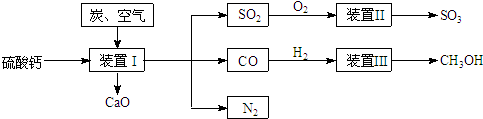
(1)生产中常在装置Ⅰ里加入SiO2,其主要作用:①生产水泥;②还可
(2)装置Ⅱ中,为了提高SO2的转化率,可采用的措施是:
A.加入V2O5作催化剂 B.采用过量SO2 C.低温 D.通入过量空气
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
2H2O(g)═2H2(g)+O2(g)△H=+484kJ?mol-1
CH3OH(g)+1/2O2(g)═CO2(g)+2H2(g)△H=-192.9kJ?mol-1
试写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式
(4)已知25℃时,Ksp(CaSO4)=7.10×10-5.在0.100L 0.200mol?L-1CaCl2溶液中加入2.72g CaSO4粉末充分搅拌后,假设溶液的体积变化忽略不计,则溶液中SO42-物质的量浓度为:

(1)生产中常在装置Ⅰ里加入SiO2,其主要作用:①生产水泥;②还可
降低反应所需温度或降低能耗
降低反应所需温度或降低能耗
.(2)装置Ⅱ中,为了提高SO2的转化率,可采用的措施是:
D
D
.A.加入V2O5作催化剂 B.采用过量SO2 C.低温 D.通入过量空气
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
2H2O(g)═2H2(g)+O2(g)△H=+484kJ?mol-1
CH3OH(g)+1/2O2(g)═CO2(g)+2H2(g)△H=-192.9kJ?mol-1
试写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式
CO(g)+2H2(g)=CH3OH(g);△H=-90.1kJ?mol-1
CO(g)+2H2(g)=CH3OH(g);△H=-90.1kJ?mol-1
;若将生成的CH3OH与氢氧化钾溶液、氧气构成燃料电池,则燃料电池的负极反应式为:CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.(4)已知25℃时,Ksp(CaSO4)=7.10×10-5.在0.100L 0.200mol?L-1CaCl2溶液中加入2.72g CaSO4粉末充分搅拌后,假设溶液的体积变化忽略不计,则溶液中SO42-物质的量浓度为:
3.55×10-4
3.55×10-4
mol?L-1.分析:(1)根据反应的反应热判断;
(2)二氧化硫和氧气的反应是一个反应前后气体体积减小的放热反应,降低温度、增大压强、增大氧气的量或减少三氧化硫的量都能使反应向正反应方向移动;
(3)根据盖斯定律写出其热化学反应方程式,燃料电池放电时,负极上燃料失电子发生氧化反应;
(4)c(SO42-)=
.
(2)二氧化硫和氧气的反应是一个反应前后气体体积减小的放热反应,降低温度、增大压强、增大氧气的量或减少三氧化硫的量都能使反应向正反应方向移动;
(3)根据盖斯定律写出其热化学反应方程式,燃料电池放电时,负极上燃料失电子发生氧化反应;
(4)c(SO42-)=
| Ksp |
| c(Ca2+) |
解答:解:(1)二氧化硅和氧化钙的反应是吸热反应,所以向装置Ⅰ里加入SiO2,还能降低反应所需温度或降低能耗,
故答案为:降低反应所需温度或降低能耗;
(2)二氧化硫和氧气生成三氧化硫的反应是一个反应前后气体体积减小的放热反应,降低温度、增大压强、增大氧气的量或减少三氧化硫的量都能使反应向正反应方向移动,但温度过低,反应速率降低,不利于工业生产,所以为提高SO2的转化率,可采用的措施通入过量空气,故选D;
(3)2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
(-566kJ/mol)①
2H2O(g)═2H2(g)+O2(g)△H=+484kJ?mol-1②
CH3OH(g)+1/2O2(g)═CO2(g)+2H2(g)△H=-192.9kJ?mol-1③
将方程式①×
-③得CO(g)+2H2(g)=CH3OH(g);△H=
(-566kJ/mol)-(-192.9kJ?mol-1)=-90.1 kJ?mol-1,甲醇、氧气燃料电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CO(g)+2H2(g)=CH3OH(g);△H=-90.1 kJ?mol-1,CH3OH+8OH--6e-=CO32-+6H2O;
(4)c(SO42-)=
=
mol/L=3.55×10-4 mol/L,故答案为:3.55×10-4.
故答案为:降低反应所需温度或降低能耗;
(2)二氧化硫和氧气生成三氧化硫的反应是一个反应前后气体体积减小的放热反应,降低温度、增大压强、增大氧气的量或减少三氧化硫的量都能使反应向正反应方向移动,但温度过低,反应速率降低,不利于工业生产,所以为提高SO2的转化率,可采用的措施通入过量空气,故选D;
(3)2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
| 1 |
| 2 |
2H2O(g)═2H2(g)+O2(g)△H=+484kJ?mol-1②
CH3OH(g)+1/2O2(g)═CO2(g)+2H2(g)△H=-192.9kJ?mol-1③
将方程式①×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CO(g)+2H2(g)=CH3OH(g);△H=-90.1 kJ?mol-1,CH3OH+8OH--6e-=CO32-+6H2O;
(4)c(SO42-)=
| Ksp |
| c(Ca2+) |
| 7.10×10-5 |
| 0.2 |
点评:本题考查较综合,涉及溶度积常数的有关计算、盖斯定律、化学平衡移动的影响因素等知识点,外界条件对化学平衡的影响是考查热点,要注意反应前后气体体积是否变化,为易错点.

练习册系列答案
相关题目
 +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:
。
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:
。