题目内容
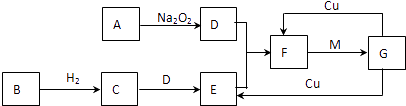
【题目】用铅蓄电池电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中正确的是 ( )

A. 铅蓄电池放电时的正极反应是:PbO2+4H+ +2e- =Pb2++2H2O
B. 忽略能量消耗,当b极产生0.01mol气体时,铅蓄电池中消耗 0.01 molH2SO4
C. 铅蓄电池充电时,A极应与外接电源负极相连
D. 电解苦卤水时,a 电极首先放电的是Br―而不是Cl―,说明当其它条件相同时Br―的还原性强于Cl―
【答案】D
【解析】A. 原电池的正极发生得到电子的还原反应,则铅蓄电池放电时的正极反应是PbO2+SO42-+4H+ +2e-=PbSO4+2H2O,A错误;B. b电极与负极相连,作阴极,溶液中的氢离子得到电子,所以忽略能量消耗,当b极产生0.01mol气体即0.01mol氢气时,转移0.02mol电子,所以铅蓄电池中消耗 0.02 mol H2SO4,B错误;C. 铅蓄电池充电时,A极应与外接电源正极相连,C错误;D. 电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,a电极首先放电的是Br-而不是Cl-,D正确,答案选D。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】某同学设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应方程式是____________________,实验中预通过观察什么现象或测定什么数据来进行判断:_____________________。
(2)该实验的目的是________________________________________________。
(3)实验③中的Vx =______;实验①和④测得反应速率分别为v1、v4,则v1_____v4(填:“>”“<”和“=”)。
(4)实验①中,c(Mn2+)与t关系如右图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,还可能是________________。