题目内容
【题目】18.4 g NaHCO3和NaOH的固体混合物,在密闭容器中加热到约250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g,试计算原混合物中NaOH的质量分数。
【答案】54.3%
【解析】为了方便计算,在进行有关混合物加热反应的计算时,要先考虑两者之间的反应,如果某物质过量且能分解,则再考虑两者反应后的分解反应。
假设18.4g混合物按下式恰好完全反应
NaHCO3+NaOH![]() Na2CO3+H2O Δm
Na2CO3+H2O Δm
84 40 106 18
此时固体质量减少:18.4 g×![]() ≈2.67 g
≈2.67 g
当NaHCO3过量时,过量的NaHCO3会分解放出CO2和H2O(固体质量减少幅度大),此时,固体质量减少值应大于2.67 g;反过来,固体质量减少值小于2.67 g。
现混合物的质量减少了18.4-16.6=1.8(g)<2.67(g),由此可推知原混合物中NaOH过量。设原混合物中NaOH的质量为x,则原混合物中NaHCO3的质量为18.4 g-x。
NaOH+NaHCO3===Na2CO3+H2O 固体质量减少
84 18
18.4g-x 1.8 g
列式解得x=10 g,故原混合物中NaOH的质量分数为![]() ×100%≈54.3%。
×100%≈54.3%。

练习册系列答案
相关题目
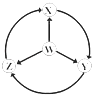
【题目】如图W,X,Y,Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
A.A
B.B
C.C
D.D