题目内容
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
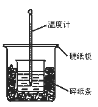
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”“不相等”),所求中和热___(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___。(填“偏大”“偏小”“无影响”)
【答案】环形玻璃搅拌棒 隔热保温减少热量的损失 偏小 不相等 相等 偏小
【解析】
根据题中装置图可知,本题考查中和热的测定,运用测定中和热的步骤,计算中和热的方法分析。
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒。
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失。
故答案为:隔热保温减少热量的损失
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小。
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL 0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,所以所放出的热量不相等;但是中和热是强酸与强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以所求中和热相等;用相同浓度和体积的氨水代替NaOH溶液进行上述实验,因NH3H2O是弱电解质,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小。
故答案为:不相等; 相等; 偏小。

【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
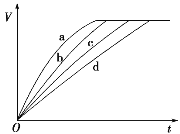
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容密闭容器中达到平衡后,若仅改变图中横轴x的值,纵轴y随x变化趋势合理的是( )
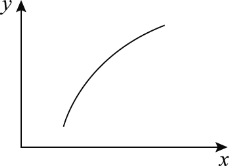
选项 | x | y |
A | CO的物质的量 | CO2与CO的物质的量之比 |
B | 反应温度 | 逆反应速率 |
C | 体系压强 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
A.AB.BC.CD.D