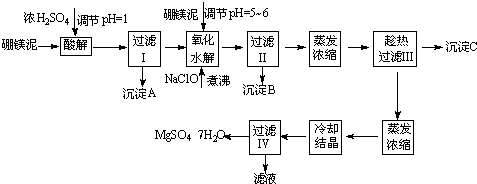
��Ŀ����
��2009?�㶫ģ�⣩ͨ������¿�����CO2���������Ϊ0.030%����������CO2�������������0.050%ʱ�����������Ե�����ЧӦ��Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
��1��Ŀǰ���ó��ٽ�CO2����״̬������̬��Һ̬֮�䣩�����������������ѳ�Ϊһ�����ƣ���һ�����Ի����Ļ�����������
��2������п�ѧ���������ɫ���ɡ����룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״�������ɫ���ɡ����뼼���������£�

�ٷֽ���з�Ӧ�Ļ�ѧ����ʽΪ
���ںϳ����У�����4.4kg CO2������H2ǡ����ȫ��Ӧ��������̬��ˮ�ͼ״����ɷų�4947kJ����������д���ϳ����з�����Ӧ���Ȼ�ѧ����ʽ
��3��С��ͬѧ���ó������ⶨ������CO2����������������CaCO3��BaCO3���ܶȻ���Ksp���ֱ�Ϊ4.96��10-9��2.58��10-11��
С��Ӧ��ѡ�õ��Լ���
��1��Ŀǰ���ó��ٽ�CO2����״̬������̬��Һ̬֮�䣩�����������������ѳ�Ϊһ�����ƣ���һ�����Ի����Ļ�����������
����������
����������
����2������п�ѧ���������ɫ���ɡ����룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״�������ɫ���ɡ����뼼���������£�

�ٷֽ���з�Ӧ�Ļ�ѧ����ʽΪ
2KHCO3
K2CO3+CO2��+H2O
| ||
2KHCO3
K2CO3+CO2��+H2O
��
| ||
���ںϳ����У�����4.4kg CO2������H2ǡ����ȫ��Ӧ��������̬��ˮ�ͼ״����ɷų�4947kJ����������д���ϳ����з�����Ӧ���Ȼ�ѧ����ʽ
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol
����3��С��ͬѧ���ó������ⶨ������CO2����������������CaCO3��BaCO3���ܶȻ���Ksp���ֱ�Ϊ4.96��10-9��2.58��10-11��
С��Ӧ��ѡ�õ��Լ���
Ba��OH��2����NaOH��Һ��BaCl2��Һ��
Ba��OH��2����NaOH��Һ��BaCl2��Һ��
��ʵ��ʱ�ⶨ�����ݳ�����������⣬����Ҫ�ⶨʵ��ʱ���¶ȡ�ѹǿ������������
ʵ��ʱ���¶ȡ�ѹǿ������������
����������1�����ݷ������ܲ�����ԭ�ӣ�����ԭ���dz����ֽ�Ĵ�����
��2���ٸ���̼��������ȷֽ�Ļ�ѧ���ʻش�
�ںϳ����з�����ӦΪ������̼��������Ӧ���ɼ״���ˮ������4.4 kg CO2������H2ǡ����ȫ��Ӧ���ɷų�4 947 kJ����������1 mol CO2�������ϳɼ״��ų�����49.47 kJ����������д�Ȼ�ѧ��Ӧ����ʽʱ��Ӧע������״̬����Ӧ�ȵ��������Լ���λ��
��3������CaCO3��BaCO3���ܶȻ���С��֪BaCO3�����ܣ������CO2����BaCO3��Ӧ����ȫ��
��2���ٸ���̼��������ȷֽ�Ļ�ѧ���ʻش�
�ںϳ����з�����ӦΪ������̼��������Ӧ���ɼ״���ˮ������4.4 kg CO2������H2ǡ����ȫ��Ӧ���ɷų�4 947 kJ����������1 mol CO2�������ϳɼ״��ų�����49.47 kJ����������д�Ȼ�ѧ��Ӧ����ʽʱ��Ӧע������״̬����Ӧ�ȵ��������Լ���λ��
��3������CaCO3��BaCO3���ܶȻ���С��֪BaCO3�����ܣ������CO2����BaCO3��Ӧ����ȫ��
����⣺��1���������ڿ������ܲ�����ԭ�ӣ�����ԭ���dz����ֽ�Ĵ�����CO2��������ɷ�ֹ�������ƻ����ʴ�Ϊ�����������㣻
��2����̼��������ȿɷֽ��̼��ء�������̼��ˮ������ʽΪ��2KHCO3
K2CO3+H2O+CO2�����ʴ�Ϊ��2KHCO3
K2CO3+H2O+CO2����
�ڸ���4.4 kg CO2������H2ǡ����ȫ��Ӧ���ɷų�4 947 kJ����������1 mol CO2�������ϳɼ״��ų�����49.47 kJ�������������Ȼ�ѧ����ʽΪCO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol���ʴ�Ϊ��CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol��
��3������CaCO3��BaCO3���ܶȻ���С��֪BaCO3�����ܣ������CO2����BaCO3��Ӧ����ȫ���ʿ�ѡ��Ba��OH��2����NaOH��Һ��BaCl2��Һ����ΪCO2�ij��������ⶨ�����ݳ�����������⣬����Ҫ�ⶨʵ��ʱ���¶ȡ�ѹǿ���������������ʴ�Ϊ��Ba��OH��2����NaOH��Һ��BaCl2��Һ����ʵ��ʱ���¶ȡ�ѹǿ��������������
��2����̼��������ȿɷֽ��̼��ء�������̼��ˮ������ʽΪ��2KHCO3
| ||
| ||
�ڸ���4.4 kg CO2������H2ǡ����ȫ��Ӧ���ɷų�4 947 kJ����������1 mol CO2�������ϳɼ״��ų�����49.47 kJ�������������Ȼ�ѧ����ʽΪCO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol���ʴ�Ϊ��CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol��
��3������CaCO3��BaCO3���ܶȻ���С��֪BaCO3�����ܣ������CO2����BaCO3��Ӧ����ȫ���ʿ�ѡ��Ba��OH��2����NaOH��Һ��BaCl2��Һ����ΪCO2�ij��������ⶨ�����ݳ�����������⣬����Ҫ�ⶨʵ��ʱ���¶ȡ�ѹǿ���������������ʴ�Ϊ��Ba��OH��2����NaOH��Һ��BaCl2��Һ����ʵ��ʱ���¶ȡ�ѹǿ��������������
�����������Զ�CO2�������õ��о�Ϊ���壬�����Ȼ�ѧ����ʽ��������ѡ���֪ʶ���Ѷ��еȣ�ּ�ڿ���ѧ����֪ʶ�����ռ�Ǩ������������

��ϰ��ϵ�д�
�����Ŀ

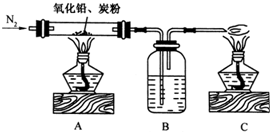 ��2009?�㶫ģ�⣩ij����С����ͨ��ʵ��֤����Ǧ��ֽ����ð�ɫ��ĩ�к�����Ԫ�أ�������µ�ʵ��װ�ã�
��2009?�㶫ģ�⣩ij����С����ͨ��ʵ��֤����Ǧ��ֽ����ð�ɫ��ĩ�к�����Ԫ�أ�������µ�ʵ��װ�ã�