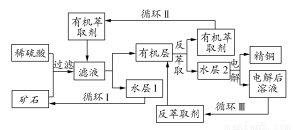
题目内容
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断正确的是( )
A.该混盐中氯元素的化合价为-1
B.该混盐的水溶液呈中性
C.该混盐与盐酸反应产生1 mol Cl2时转移2 mol电子
D.该混盐具有和漂白粉相似的化学性质
D
【解析】准确判断该混盐中的两种酸根离子是解题的关键,它们分别是次氯酸根离子和氯离子。氯元素的化合价应该分别为+1和-1,A错误;该混盐的水溶液呈碱性,B错误;C项中转移的电子数应该为1 mol;D显然正确。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案除去下列物质中的杂质(括号中为杂质)选用试剂正确的是( )
A.Fe2O3(Al2O3)用盐酸
B.Fe2O3(Al2O3)用氨水
C.Mg(Al)用纯碱溶液
D.MgCl2(AlCl3)用氢氧化钠溶液和盐酸
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
| X | Y | Z |
I1 | 496 | 738 | 578 |
I2 | 4562 | 1451 | 1817 |
I3 | 6912 | 7733 | 2745 |
I4 | 9543 | 10540 | 11575 |
(1)三种元素电负性大小关系为 。
(2)写出Y原子的电子排布式 ,Y的第一电离能大于Z的第一电离能的原因 。
(3)X晶体采用下列 (填字母)堆积方式。
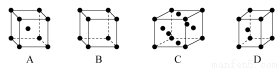
(4)含有元素X的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
(5)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。