题目内容
下列关于卤族元素的比较中,错误的是
| A.气态氢化物的稳定性:HF>HCl>HBr>HI | B.单质的氧化性:F2>Cl2>Br2>I2 |
| C.离子的还原性:F->Cl->Br->I- | D.元素的非金属性:F>Cl>Br>I |
C
试题分析:卤族元素从F到I,非金属性减弱(D正确),气态氢化物稳定性减弱(A正确),单质氧化性减弱(B正确),阴离子还原性增强(C错误)。
点评:卤族元素从F到I,阴离子还原性增强,对应氢卤酸酸性、还原性均增强。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
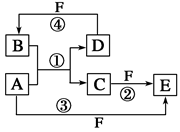
 种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的
种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的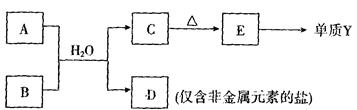
 2CA3(g)
2CA3(g) .0 L.
.0 L.